
分析 热化学方程式中需注明物质的状态,物质的量与热量成正比,焓变的数值、单位、符号缺一不可,以此来解答.
解答 解:(1)1mol N2H4(l)在氧气(g)中燃烧,生成氮气(g)和水(l),放出622KJ热量,反应的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
(2)0.1molC2H2(g)完全燃烧生成液态水放出129.9KJ的热量,可知1molC2H2(g)完全燃烧生成液态水放出1299KJ,热化学方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1299 kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1299 kJ/mol;
(3)1molN2(g)与足量O2(g)反应生成NO2(g),吸收68KJ热量,则热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68 kJ/mol,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ/mol;
(4)1gFeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)放出7.1KJ的热量,则1molFeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)放出热量为7.1kJ×120=852kJ,则热化学方程式为FeS2(s)+$\frac{11}{2}$O2(g)=$\frac{1}{2}$Fe2O3(s)+2SO2(g)△H=-852kJ/mol,
故答案为:FeS2(s)+$\frac{11}{2}$O2(g)=$\frac{1}{2}$Fe2O3(s)+2SO2(g)△H=-852kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、热化学方程式的书写方法为解答的关键,侧重分析与应用能力的考查,注意吸热反应的焓变为正,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: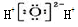 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
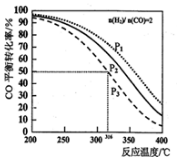
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
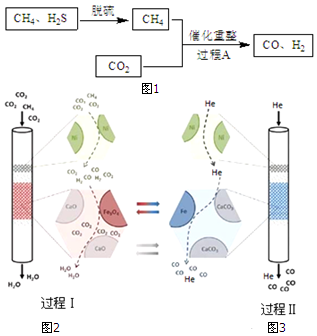
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com