解答:
解:(1)a、0.1mol?L
-1的CH
3COOH溶液加稀释过程中,电离程度增大,溶液体积增大,则c(H
+)减小,故a错误;
b、0.1mol?L
-1的CH
3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H
+)减小的程度小于c(CH
3COOH)的减小程度,所以
增大,故b正确;
c、Kw=c(H
+)?c(OH
-)只受温度的影响,温度不变则其值是一个常数,故c错误;
d、醋酸稀释,酸性减弱,c(H
+)减小,碱性增强,c(OH
-)增大,即
增大,故d正确;
e、Ka=
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
只受温度的影响,温度不变则其值是一个常数,故e错误;
故答案为:bd;
(2)根据CH
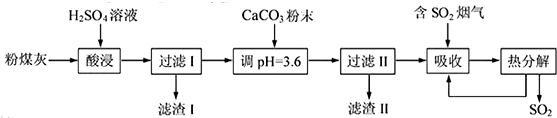
3COOH与一元酸HX加水稀释过程中pH与溶液体积的关系图可以看出HX酸在稀释过程中溶液的PH变化比醋酸的大,所以酸性HX强于醋酸,电离程度:HX>CH
3COOH,
故答案为:大于;稀释相同倍数,一元酸HX的pH变化比醋酸大,故酸性强,电离平衡常数大;
II、(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H
2(g)+
O
2(g)=H
2O(g)△H=-241.8kJ/mol,
故答案为:H
2(g)+
O
2(g)=H
2O(g)△H=-241.8kJ/mol;
(2)1mol N
2 (g)与适量O
2(g)起反应,生成NO
2(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N
2(g)+2O
2(g)=2NO
2(g)△H=+68kJ/mol,
故答案为:N
2(g)+2O
2(g)=2NO
2(g)△H=+68kJ/mol;
(3)放热时焓变值为负值,1mol Cu(s)与适量O
2(g)起反应,生成CuO(s),放出157kJ热量的热化学方程式为Cu(s)+
O
2(g)=CuO(s);△H=-157kJ/mol,
故答案为:Cu(s)+
O
2(g)=CuO(s)△H=-157kJ/mol;
(4)1molC与1mol水蒸气反应生成1mol CO和1mol H
2,吸收131.5kJ的热量,则热化学方程式为:C (S)+H
2O (g)?CO (g)+H
2 (g)△H=+131.5kJ?mol
-1,故答案为:C (S)+H
2O (g)?CO (g)+H
2 (g)△H=+131.5kJ/mol;
(5)1mol N
2H
4(l)在O
2(g)中燃烧,生成N
2(g)和H2O(l),放出622kJ热量放热时焓变值为负值,所以该反应的热化学方程式为N
2H
4(g)+O
2(g)=N
2(g)+2H
2O(l)△H=-622kJ/mol,
故答案为:N
2H
4(g)+O
2(g)=N
2(g)+2H
2O(l)△H=-622kJ/mol;
(6)1molC
8H
18(l)在与O
2(g)中燃烧,生成CO
2(g)和H
2O(l),放出5518kJ热量,该反应的热化学方程式为C
8H
18(l)+
O
2(g)=8CO
2(g)+9H
2O(l)△H=-5518kJ/mol;
故答案为:C
8H
18(l)+
O
2(g)=8CO
2(g)+9H
2O(l)△H=-5518kJ/mol.

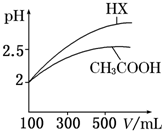 回答下列问题:
回答下列问题:

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案