
| A、常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
| D、10LpH=1的硫酸溶液中含有的H+离子数为2NA |


科目:高中化学 来源: 题型:
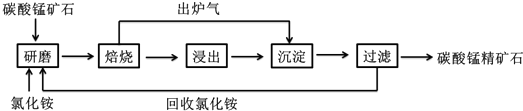
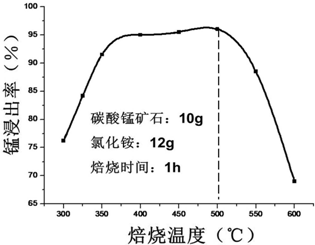
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、⑤ | C、②③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、AlO2─、Cl─ |
| B、Al3+、NH4+、CO32-、Cl─ |
| C、K+、Na+、ClO─、SO32─ |
| D、Na+、Ba2+、OH─、NO3─ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打用于焙制糕点 |
| B、碳酸钙可用作补钙剂 |
| C、烧碱用于改良酸性土壤 |
| D、盐酸可用于清除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
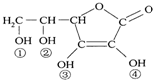 维生素(如图)C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素(如图)C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A、维生素不能和氢氧化钠溶液反应 |
| B、维生素C由于含有酯基而难溶于水 |
| C、维生素C由于含有C=O键而能发生银镜反应 |
| D、维生素C的酸性可能是③、④两个羟基引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向无色溶液中滴加氯水和CCl4,振荡静置 | 下层溶液显紫色 | 溶液中含有I- |
| B | 过量铁粉加入稀硝酸中充分反应,再加入 KSCN溶液 | 溶液呈红色 | 稀硝酸将铁氧化为Fe3+ |
| C | 向淀粉溶液中滴加稀硫酸,加热,取出水 解液少许,滴加银氨溶液,并水浴加热 | 没有银镜出现 | 淀粉没有发生水解 |
| D | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com