
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
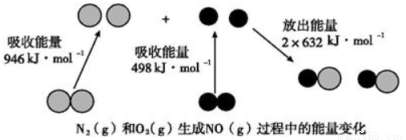
下列说法中正确的是
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年宁夏中卫一中高一下第三次月考化学试卷(解析版) 题型:选择题
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
A.v(H2)=0.03 mol/(L•min) B.v(N2)=0.02 mol/(L•min)
C.v(NH3)=0.17 mol/(L•min) D.v(NH3)=0.01 mol/(L•min)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:简答题
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.已知: ① 4HCl(g)+O2(g) 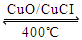 2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
②H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
由知断开1mol H-H键所需能量为436kJ;断开1molO=O键所需能量为496kJ;断开1molCl-Cl键所需能量为243KJ。则
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1molH-O键所需能量为 kJ。
Ⅱ.已知: CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJ•mol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJ•mol-1 ②
又知CH4的燃烧热为890.3kJ/mol。
(1)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中B表示的微粒是_______(填名称),等质量的A、H2化学能较低的物质是_______(填化学式)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
下列各组物质中漂白原理相同的是( )
A.漂白粉和二氧化氯 B.二氧化硫和次氯酸 C.二氧化硫和漂白粉 D.活性炭和二氧化硫
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
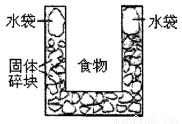
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷参考版) 题型:实验题
无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
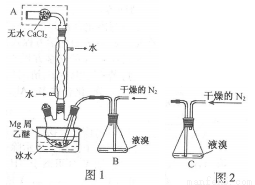
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:填空题
以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

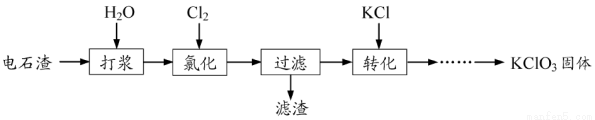
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤。
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
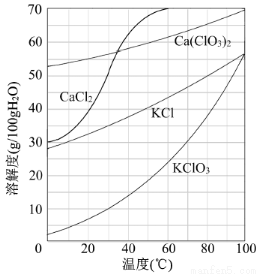
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g?L-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国3卷参考版) 题型:简答题
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1 。反应一段时间后溶液中离子浓度的分析结果如下表》
离子 | SO42? | SO32? | NO3? | NO2? | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2?+2SO32?===2SO42?+Cl?的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH? (aq) ===SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) ===SO42? (aq)+Cl? (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42?(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) === CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com