
【题目】2009年,M IT的唐纳德·撒多维教授领导的小组研制出一种镁锑液态金属储能电池。电池突破了传统电池设计理念,以NaCl、KCl和MgCl2的熔融盐作为电解质。以Mg和Sb两极金属,整个电池在700℃工作,处在液体状态。由于密度的不同,在重力下分层,分别形成上层金属Mg,下层金属Sb和中间的NaCl、KCl及MgCl2电解质层。电池的工作原理如图所示,关于该电池的说法不正确的是 ( )
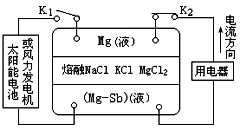
A. 电池充电时Cl—从上向下移动
B. 电池放电时正极的电极反应式为Mg2++2e—=Mg
C. 电池充电时阳极的电极反应式为:2Cl—-2e—=Cl2↑
D. 电池充电时中层熔融盐的组成不发生改变
【答案】C
【解析】
中间层熔融盐为电解质溶液,依据电流方向,镁液为原电池负极,充电时镁极为阴极。该电池工作时,负极Mg失电子生成镁离子,电极反应Mg-2e-=Mg2+,正极镁离子得电子得到Mg,电极反应为:Mg2++2e-=Mg。;充电时,Mg电极与负极相连作阴极,Mg-Sb电极与正极相连作阳极。A. 电池充电时为电解池,阴离子移向阳极,即向下移动,因此Cl—从上向下移动,故A正确;B. 电池放电时为原电池,正极的电极反应式为Mg2++2e—=Mg,故B正确;C. 电池充电时为电解池,阳极的电极反应式为Mg-2e-=Mg2+,故C错误;D. 根据上述分析,电池放电和充电时中层熔融盐的组成都不发生改变,故D正确;故选C。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质微粒直径在10-9~10-7m之间
B.用平行光照射FeCl3溶液和Fe(OH)3胶体时,均能产生丁达尔现象
C.向豆浆中加入盐卤做豆腐是胶体聚沉在生活中的具体应用
D.溶液、胶体、浊液均属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品卫生与人们的身体健康密切相关,下列做法符合《食品卫生法》的是( )
A.用工业用盐腌制咸菜B.用小苏打发酵面粉
C.在牛奶中添加尿素D.用二氧化硫熏制银耳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C(反应放热)分两步进行:①A+B→X(反应吸热),②X→C(反应放热)。下列示意图中,能正确表示总反应过程中能量变化的( )
A. 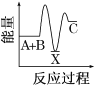 B.
B. 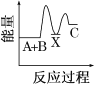
C. 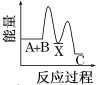 D.
D. 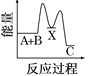
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是( )
A. 容器①、②中反应的平衡常数相等
B. 平衡时,两个容器中NH3的体积分数均为1/7
C. 容器②中达平衡时放出的热量Q=23.15kJ
D. 若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
用化学用语回答下列问题:
(1)写出二硫化碳分子的电子式:__________
(2)写出氮气分子的结构式:__________
(3)A+、B-、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B-![]() C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
(4)用电子式表示MgCl2的形成过程__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com