


| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
分析 (1)根据仪器用途填写名称,仪器a是反应容器属于圆底烧瓶;
(2)根据装置气密性检查方法分析,装置密闭后通过改变温度改变压强,观察导气管插入水中是否冒气泡,恢复常温观察导气管中是否上升一段水柱判断装置气密性;
(3)氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,根据复分解反应的特点及书写方程式的原则写出化学方程式;
依据试剂特点和反应生成产物选择装置,浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体;
利用氢氧化钠固体溶解放热促进氨水溶液中平衡向放氨气的方向进行分析氢氧化钠的作用;
(4)根据氧化铜中氧元素的质量等于生成的水中氧元素的质量,根据氮气的体积计算出氮气的物质的量,从而求出氮原子的个数;
(5)浓硫酸具有吸水性及能与氨气反应进行分析,在洗气瓶D前的位置应增加了一个装有碱石灰(无水硫酸铜、氢氧化钠、氧化钙等)的实验仪器只吸收水,利用浓硫酸吸收氨气,得到正确的结果;
解答 解:(1)仪器a的名称为:圆底烧瓶,
故答案为:圆底烧瓶;
(2)检查A装置气密性的具体操作方法是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱,
故答案为:连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱;
(3)甲小组:氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,反应的化学方程式为(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4,
故答案为:(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4;
乙小组:浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:B;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出;
(4)反应前氧化铜的质量为m1g、氧化铜反应后转化成的铜的质量为m2g,则氧化铜中氧元素的质量为m1-m2,生成的水中氧元素的质量等于氧化铜氧元素的质量,则生成的水中氧原子的个数为$\frac{{m}_{1}-{m}_{2}}{16}$;水中氢原子个数是氧原子个数的两倍,因此氢原子个数为$\frac{{m}_{1}-{m}_{2}}{16}$×2,生成的氮气在标准状况下的体积V1L,则氮气中氮原子的个数为$\frac{{V}_{1}×2}{22.4}$;
因此氮氢原子个数比为$\frac{{V}_{1}×2}{22.4}$:$\frac{{m}_{1}-{m}_{2}}{16}$×2=5V1:7(m1-m2),
故答案为:5V1:7(m1-m2);
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高. 因此在洗气瓶D前的位置应增加了一个装有碱石灰(无水硫酸铜、氢氧化钠、氧化钙等)的实验仪器只吸收水,减小误差,
故答案为:洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高;碱石灰(氢氧化钠、氧化钙等).
点评 本题是一道综合性很强的实验探究题,要求学生具有分析和解决问题的能力,主要是物质探究物质组成和方法的应用,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:选择题
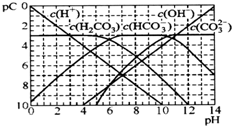
| A. | H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 | |
| B. | H2CO3电离平衡常数Kal≈10-6 | |
| C. | pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | pH=9时,溶液中存在关系(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
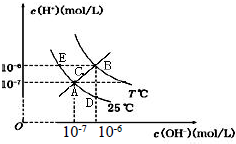
| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
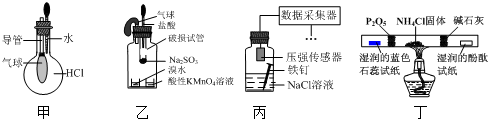
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分散系的分类 | B. | 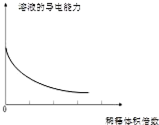 稀释浓氢氧化钠溶液的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
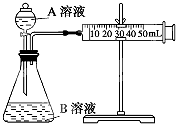 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com