
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
【答案】C
【解析】
①一个N≡N断裂的同时,有3个H-H键断裂,表示的都是正反应速率,无法判断正逆反应速率是否相等,故①错误;
②一个N≡N键断裂的同时,有6个N-H键断裂,正逆反应速率相等,达到了平衡状态,故②正确;
③反应过程中气体的总质量不会发生变化,但正反应是个气体分子数减小的反应,混合气体平均摩尔质量不再改变,说明气体总的物质的量不再改变即达到了平衡状态,故③正确;
④反应方程式两边气体的体积不相等,保持其它条件不变,当体系压强不再改变时,说明正逆反应速率相等,达到了平衡状态,故④正确;
⑤NH3、N2、H2的体积分数都不再改变,说明各组分的浓度不变,达到了平衡状态,故⑤正确;
⑥恒温恒容时,混合气体的密度保持不变,由于气体的质量不变,容器的容积不变,所以气体的密度始终不变,故密度不变时无法判断是否达到平衡状态,故⑥错误;
⑦正反应速率υ(H2)=0.6mol·L·min–1,逆反应速率υ(NH3)=0.4 mol·L·min–1,逆反应速率υ(H2)=0.6 mol·L·min–1,则氢气的正逆反应速率相等,达到了平衡状态,故⑦正确。
综上所述正确答案为C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是
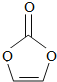
A. 分子式为C3H4O3
B. 1mol该分子能与2molH2加成
C. 分子中只有极性键
D. 标准状况下8.6g该物质完全燃烧得到6.72LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 mol·L-1 (NH4)2SO4溶液中逐滴加入0.200 0 mol·L-1 NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑NH3·H2O的分解)。下列说法不正确的是( )
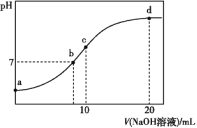
A.点a所示溶液中:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.点b所示溶液中:c(![]() )=c(Na+)>c(H+)=c(OH-)
)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(![]() )+c(H+)+c(Na+)=c(OH-)+2c(
)+c(H+)+c(Na+)=c(OH-)+2c(![]() )
)
D.点d所示溶液中:c(![]() )+c(NH3·H2O)=0.100 0 mol·L-1
)+c(NH3·H2O)=0.100 0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纯碱和小苏打的叙述中正确的是( )
A.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B.等质量的Na2CO3、NaHCO3分别与足量的同浓度的盐酸反应,NaHCO3消耗的盐酸比Na2CO3多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.等质量的Na2CO3、NaHCO3分别与足量的稀H2SO4反应,NaHCO3产生CO2比Na2CO3多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证还原性:SO2>Fe2+>C1-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有
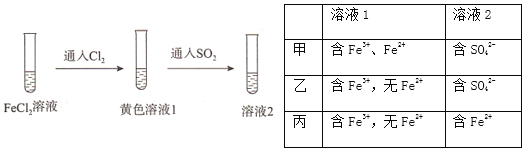
A. 只有甲 B. 甲、乙 C. 甲、丙 D. 甲、乙、丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
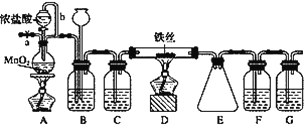
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为______________________________。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________, ___________(填试剂名称和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为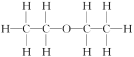 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
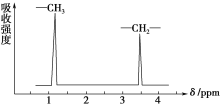
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。
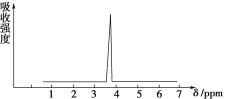
A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④均为燃烧反应。
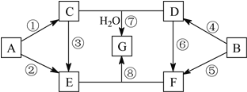
请回答下列问题:
(1)D的化学式____________,G的化学式____________。
(2)按要求写出下列反应的方程式:
③的化学方程式:___________________,
B与E的溶液反应的离子方程式:________________。
(3)将E的溶液逐滴加入到F的溶液中至过量,其现象是_____,总反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是:有气体生成,电流计指针发生偏转 |
①通过实验2和3,可得出原电池的形成条件是______________;
②通过实验1和3,可得出原电池的形成条件是_______________;
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是_______;
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________;Cu棒:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com