
| A. | CO2 | B. | CH4 | C. | C2H4 | D. | NH4Cl |
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
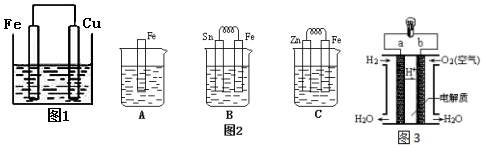
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
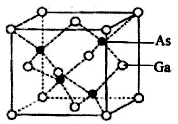 氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题: ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.
,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com