
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】D
【解析】
A.碳酸钙难溶于水,不能写成离子形式,碳酸钙溶于水的完全电离,属于强电解质,离子方程式和评价均不正确,A错误;
B.向AlCl3溶液中加入过量的氨水,由于NH3·H2O是弱碱,不能溶解两性物质,所以反应产生Al(OH)3沉淀,评价不正确,B错误;
C.NaHCO3的水解,消耗水电离产生H+,结合形成H2CO3,同时产生OH-,离子方程式和评价都错误,故C错误;
D.由于还原性Fe2+>Br-,所以等物质的量的FeBr2和Cl2反应,首先氧化Fe2+,Fe2+全部被氧化,Br-一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
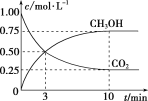
①0~10 min内,氢气的平均反应速率为____________,第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;2H2(g)+O2(g)===2H2O(g) ΔH=-b kJ·mol-1;H2O(g)===H2O(l) ΔH=-c kJ·mol-1;CH3OH(g)===CH3OH(l) ΔH=-d kJ·mol-1。则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)如图,25 ℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解600 mL一定浓度的NaCl溶液,电池的负极反应式为_________________________________。
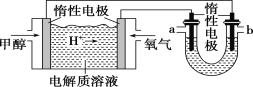
在电解一段时间后,NaCl溶液的 pH 变为12(假设电解前后NaCl溶液的体积不变,阳极产物只有Cl2),则理论上消耗甲醇的物质的量为________mol。
(3)向(2)U形管内电解后的溶液(假设NaCl溶液完全被电解)中通入标准状况下89.6 mL 的CO2气体,则所得溶液呈________(填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3)和铝矿渣(主要含Al2O3和SiO2)制备七铝十二钙的工艺如下:
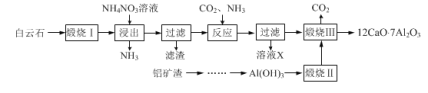
已知“煅烧Ⅲ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑
12CaO·7Al2O3+12CO2↑
(1)写出“浸出”过程中CaO与NH4NO3溶液反应的化学方程式:___。
(2)检验“浸出”过程中有NH3生成的方法是:___。
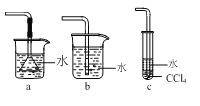
(3)如图所示装置中可用于实验室吸收NH3的是___(填字母)。
(4)溶液X中所含主要溶质的化学式为____。
(5)设计由铝矿渣制取Al(OH)3的方法,并简述过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的相对分子质量比乙的相对分子质量小
D.甲的物质的量比乙的物质的量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01mol某气体的质量为0.44g,则该气体的密度为________g·L-1(保留小数点后两位),该气体的相对分子质量为________。
(3)将4g NaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为______;取出10mL此溶液,将此10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
(4)硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色等多种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用Sx表示,对下列蒸气测定的结果是:无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为:______。
(5)把18.0mol/L的浓硫酸稀释成2.00mol/L的稀硫酸100mL,下列操作对所配溶液浓度造成的后果,属于“偏低”的是______________
①未洗涤稀释过浓硫酸的小烧杯;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥;
⑤定容时俯视刻度;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240![]() ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与对应实验操作相符合的是( )
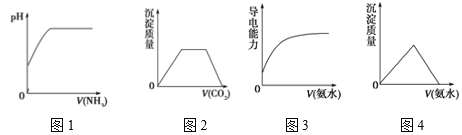
A. 图1 表示在水中慢慢通入氨气至过量
B. 图2表示在氢氧化钠和偏铝酸钠混合溶液中通入二氧化碳至过量
C. 图3表示在醋酸溶液中慢慢滴加同浓度的氨水至过量
D. 图4表示在氯化铝溶液中滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a 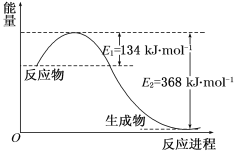 b
b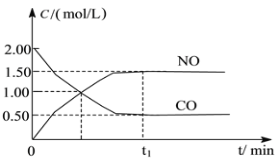
(1)写出NO2和CO反应的热化学方程式_______________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=__________。
(3)此温度下该反应的平衡常数K=_________;温度降低,K________(填“变大”、“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com