
 .
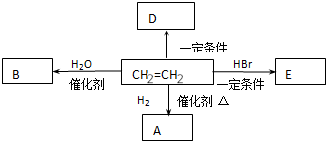
. 分析 乙烯属于不饱和烃,分子中含有碳碳双键官能团.所以可发生加成反应,和水加成生成物B是CH3CH2OH,和氢气加成生成物A是CH3-CH3,和溴化氢加成生成物E是C2H5Br.也可以在一定条件下发生加聚反应生成高分子化合物聚乙烯,以此解答该题.
解答 解:乙烯属于不饱和烃,分子中含有碳碳双键官能团.所以可发生加成反应,和水加成生成物B是CH3CH2OH,和氢气加成生成物A是CH3-CH3,和溴化氢加成生成物E是C2H5Br.也可以在一定条件下发生加聚反应生成高分子化合物聚乙烯,
(1)乙烯含有的官能团为碳碳双键,故答案为:碳碳双键;
(2)E是溴乙烷.分子式为C2H5Br,故答案为:C2H5Br;
(3)乙烯和氢气在催化作用下生成乙烷,方程式为CH2=CH2+H2 $→_{△}^{催化剂}$ CH3-CH3,故答案为:CH2=CH2+H2 $→_{△}^{催化剂}$ CH3-CH3;加成反应;
(4)乙烯含有碳碳双键,发生加聚反应生成聚乙烯,为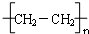 ,故答案为:
,故答案为: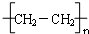 .
.
点评 本体考查有机物的合成与推断,综合考查学生的分析能力、推断能力和综合运用化学知识的能力,为高考常见题型,难度较大,注意把握题给信息,该题的关键是记住常见官能团的结构、性质以及官能团之间的相互转化,然后结合题意灵活运用即可.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 第一电离能 | 电负性 | 氢化物沸点 | 最高价氧化物对应水化物的碱性 |
| W<X | Z>Y | Y<Z | W>X |
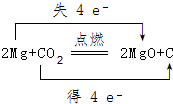 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 当各轨道处于全满.半满.全空时原子较稳定 | |
| D. | 同一周期中,碱金属元素的第一电离能最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)COOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 | |
| C. | 22.4L的CO气体与1molN2所含的电子数相等 | |
| D. | 任何条件下,16gCH4与18gH2O所含有电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I->Br ->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
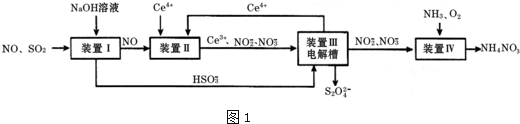
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ba2+、SO32-、ClO- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | Na+、Fe3+、S2-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com