
| A. | K:1s22s22p63s23p64s1 | B. | Fˉ:1s22s22p6 | ||
| C. | Fe:1s22s22p63s23p63d54s3 | D. | Kr:1s22s22p63s23p63d104s24p6 |
分析 主族元素原子失去电子变成阳离子时,核外电子数、电子层数、最外层电子数改变;主族元素原子得到电子变成阴离子时,核外电子数和最外层电子数改变,但电子层数不变,根据构造原理写出基态原子或离子的电子排布式.
解答 解:A.K原子核外有19个电子,其基态原子核外电子排布式为:1s22s22p63s23p64s1,故A正确;
B.氟离子核外有10个电子,其基态离子核外电子排布式为:1s22s22p6,故B正确;
C.铁是26号元素,其原子核外有26个电子,基态原子核外电子排布式为:1s22s22p63s23p63d64s2,故C错误;
D.Kr原子核外有36个电子,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p6,故D正确;
故选C.
点评 本题考查了原子或离子的核外电子排布,难度不大,明确构造原理是解本题的关键.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:实验题
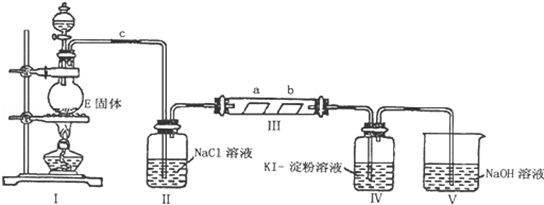
 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)| 制取的气体 | 药品 | 化学方程式 |
| O2 | H2O2MnO2 | 2H2O2═2H2O+O2↑ |
| H2 | 某溶液、Al | 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ |
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
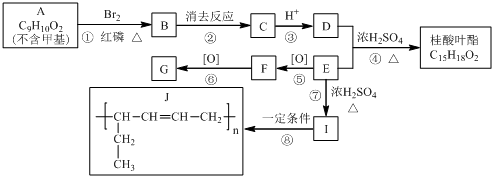
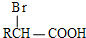 +H Br
+H Br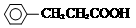 ,ICH3CH2CH=CHCH=CH2.
,ICH3CH2CH=CHCH=CH2.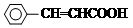 +CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$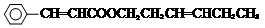 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 取一定量的废水样品,经测定其中有n(Cu2+)=0.01mol,n(Fe2+)+n(Fe3+)=0.01mol,则该水样中0mol≤n(Cl-)≤0.05mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4mL恰好完全反应,然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.16g,则废水中c(Fe3+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可以使溴水褪色是因为它有漂白性 | |
| B. | 浓硫酸可用于干燥H2S和CO2 | |
| C. | 可以用加热法除去NaCl固体中的混有的NH4Cl | |
| D. | 过量的Cu与浓硝酸反应不可能有一氧化氮生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝加到热水中 | B. | NaAlO2溶液中加入足量盐酸 | ||
| C. | 铝投入氨水中 | D. | NaOH滴入足量AlCl3溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com