
在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2⑥Ar中只含有离子键的是①,只含有共价键的是③④,既含离子键又含共价键的是②⑤,没有化学键的是⑥.
(2)写出下列物质的电子式:
CO2 NaCl H2O2
(3)用电子式表示下列化合物的形成过程:
CaF2: H3:
考点: 化学键;电子式;用电子式表示简单的离子化合物和共价化合物的形成.
分析: (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族元素和第VIA、第VIIA族元素之间易形成离子键,单原子分子中不存在化学键;
(2)共价化合物中,原子之间以共用电子对结合形成共价键,离子化合物中,离子之间通过得失电子形成离子键.
(3)氟化钙为离子化合物,阴阳离子需要标出所带电荷,氟离子需要标出最外层电子;氨气为共价化合物,分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构,据此用电子式分别表示出氟化钙、氨气的形成过程.
解答: 解:(1)①NaCl中钠离子和氯离子之间只存在离子键;
②NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
③N2中N原子之间只存在共价键;
④H2S中H原子和S原子之间只存在共价键;
⑤Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键;
⑥Ar是由单原子构成的,不存在化学键,只存在范德华力;
所以只含有离子键的是①,只含有共价键的是③④,既含离子键又含共价键的是②⑤,没有化学键的是
⑥,
故答案为:①;③④;②⑤;⑥;
(2)根据电子式书写规则知,这几种物质的电子式分别为:CO2: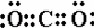 ,NaCl:,H2O2:
,NaCl:,H2O2:
故答案为: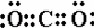 ;(3)氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为:
;(3)氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为: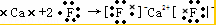 ;
;
氨气为共价化合物,分子中存在3个氮氢键,其形成过程为:3H•+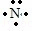 →
→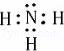 ,
,
故答案为: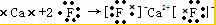 ;3H•+
;3H•+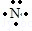 →
→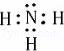 .
.
点评: 本题考查了化学键的判断、电子式的书写,明确化学键的概念、电子式的书写规则是解本题关键,难点是电子式的书写方式,注意离子键和共价键表示的区别,注意稀有气体中不存在化学键,为易错点.


科目:高中化学 来源: 题型:
下列各组元素中,第一电离能依次减小的是( )
|
| A. | H Li Na K | B. | Na Mg Al Si |
|
| C. | I Br Cl F | D. | F O N C |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是()
A. 标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA
B. 标准状况下,22.4LH2O所含有原子数为3NA
C. NA个N2分子所占的体积与0.5 NA个H2分子所占的体积比一定是2:1
D. 1.8g的NH4+离子中含有的电子数1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取溴,主要反应为:2Br﹣+Cl2=Br2+2Cl﹣,下列说法正确的是()
A. 溴离子具有氧化性 B. 氯气是还原剂
C. 该反应属于复分解反应 D. 氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是()
A. 正极附近的SO42﹣离子浓度逐渐增大
B. 正极有O2逸出
C. 电子通过导线由铜片流向锌片
D. 铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是()
A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10﹣9﹣10﹣7m之间
B. 用平行光照射可以区分FeCl3溶液和Fe(OH)3胶体
C. 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D. 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定条件的水溶液中能大量共存的粒子组是()
A. 无色透明的溶液:Fe3+、K+、OH﹣、NO3﹣
B. 与Al反应生成H2的溶液:Na+、Ma2+、NO3﹣、HCO3﹣
C. c(OH﹣)=1mol/L的溶液:K+、Ca2+、Cl﹣、H2SO3
D. CH3COOH:SO42﹣、Cl﹣、Cu2+、NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com