
| A. | 该反应的△H>0 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式CO+H2O(g)$?_{高温}^{催化剂}$CO2+H2 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应.
A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,升高温度平衡向吸热反应移动;
B、该反应前后气体的体积不发生变化,恒温恒容时,加入不反应的气体,增大压强,平衡不移动,H2的浓度不变;增大氢气的浓度,增大压强,平衡向正反应移动,平衡是氢气的浓度增大,与增大压强的方法有关;
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大;
D、反应达到平衡,平衡常数K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g).
解答 解:A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,△H>0,故A正确;
B、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故B错误.
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故C错误;
D、平衡常数K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),故D错误;
故选A.
点评 本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意对化学平衡常数的理解,同一反应,化学计量数不同,平衡常数不同.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO+O2═2NO2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 3H2+N2$?_{催化剂}^{高温高压}$3NH3 | D. | NH3+HNO3═NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
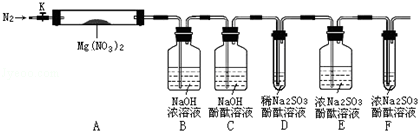
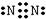 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | V、Cr、Mn的最外层电子数逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐减小 | D. | O、F、Ne的电负性逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨的pH<5.6 | |
| B. | SO2、NO2都能引起酸雨 | |
| C. | 雾霾一定是由汽车尾气引起的 | |
| D. | 空气中的SO2主要来自煤、石油的燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com