
【题目】按要求写出:
(1)一核10电子的阳离子的符号_________;
(2)两核10电子的阴离子的电子式___________;
(3)三核10电子的共价化合物的电子式_______;
(4)四核10电子的阳离子的电子式:__________;
(5)四核10电子的共价化合物的结构式_________;
(6)五核10电子的阳离子的化学式___________;
(7)五核10电子的共价化合物的结构式___________。
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24。
(1)Z原子基态核外电子排布式为_____________。
(2)元素X与Y的第一电离能较大的__________________(填元素符号);H2Y2中Y原子轨道的杂化类型为__________。
(3)+3价Z的配合物K[Z(C2O4)2(H2O)2]中的配体是____________;与C2O42-互为等电子体的一种分子的化学式为_________。
(4)Cu和Y形成的化合物的晶胞如图所示,晶胞中与铜离子距离相等且最近的铜离子有________个。某种有缺陷的铜和Y形成的化合物的晶体由Cu2+、Cu3+、Y2-及空隙组成,可表示为Cu0.98Y,则n(Cu2+)/n(Cu3+)=_________。
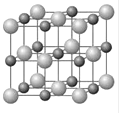
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)按要求完成下列问题:
①甲基的电子式___________。
②写出制备TNT的化学反应方程式___________。
③反式2一丁烯的结构简式___________
(2)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
①乙酸乙酯(乙醇)________;②甲苯(溴)________;
(3)下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
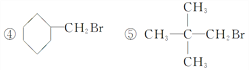
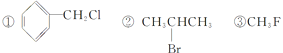

(4)实验室用纯溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作进行提纯:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗正确的操作顺序是 。
(5)某高聚物的结构式如图: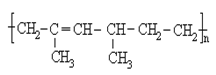 其单体的名称为
其单体的名称为
(6)某有机物的结构简式为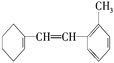 据此填写下列空格。
据此填写下列空格。
①该物质苯环上一氯代物有________种;
②1mol该物质和溴水混合,消耗Br2的物质的量为________mol;
③1mol该物质和H2加成需H2________mol;
(7)![]() 与等物质的量的Br2发生加成反应,生成的产物是
与等物质的量的Br2发生加成反应,生成的产物是


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【有机选做】有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
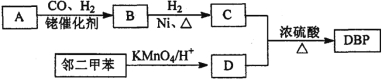
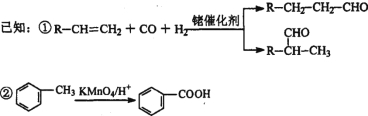
③烃A是有机合成的重要原料。A的质谱图最大m/z为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。
回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为_______________。
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________。
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C![]() 中间产物 ii)中间产物+C
中间产物 ii)中间产物+C ![]() DBP+H2O
DBP+H2O
①请猜测E的结构简式___________。[
②工业上生产有机物E的反应如下:2X+9O2![]() 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
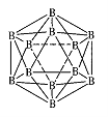
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W结构中含有三个六元环,是一种新型香料的主要成分之一。W的合成路线如下(部分产物和部分反应条件略去):
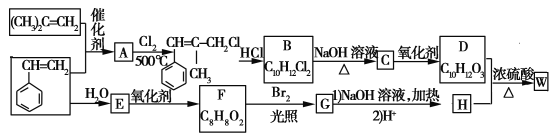
已知:①RCH===CH2+CH2===CHR′CH2===CH2+RCH===CHR′
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子
③D和H是同系物
请回答下列问题:
(1)G分子中含有的官能团名称是 。
(2)A→B反应过程中涉及的反应类型有 、 。
(3)W的结构简式为 。
(4)B→C的化学方程式为 ;由D生成高分子化合物的方程式为 。[
(5)同时满足下列条件的F的同分异构体有 种(不包括立体异构):
①能发生银镜反应;②能发生水解反应。
其中核磁共振氢谱为5组峰的为 (写结构简式),其峰面积之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
①实验步骤b明显不合理,理由是 。
②实验步骤d中用少量冰水洗涤晶体,其目的是 , 。
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。硫酸亚铁的溶解度和析出晶体的组成
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
(3)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为 .
![]() (4)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(4)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
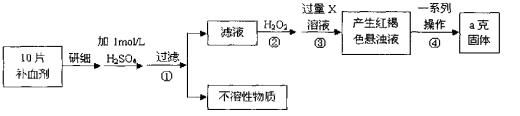
请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
②步骤④中一系列处理的操作步骤:过滤、 、灼烧、
③若实验无损耗,则每片补血剂含铁元素的质量 g。
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是 。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是 (用实验中提供的试剂)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com