
X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X的气态氢化物分子中只有一对孤电子对;Y、Z、W的最高价氧化物对应的水化物可以两两相互反应。
(1)X在周期表中的位置是________;Z3+的核外电子排布式为________。
(2)Y、Z、R的第一电离能的大小顺序为________(用元素符号表示)。
(3)W的最高正价氧化物的分子构型为________;将该氧化物溶于水,则所得溶液中阴离子中的W杂化轨道类型为________。
(4)将R的单质与Y的最高价氧化物对应的水化物混合,其反应的离子方程式为________________________________________________________________________。
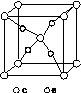
(5)图K332所示为Y、Z形成的合金晶胞结构,如果将含1 mol Y的该合金置于足量的水中充分反应,放出标准状况下气体的体积为________L。

图K332
(1)第二周期第ⅤA族 1s22s22p6
(2)Na<Al<Cl
(3)平面三角形 sp3
(4)Cl2+2OH-===ClO-+Cl-+H2O
(5)44.8
[解析] X的气态氢化物中只有一对孤电子对且为五种元素中原子序数最小的元素,故X为氮元素;Y、Z、W的最高价氧化物对应的水化物可以两两反应,则分别为Na、Al、S,R为Cl。
(3)硫的最高价氧化物为SO3,硫原子的价层电子对数为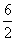 =3,则SO3中的硫原子为sp2杂化,分子空间结构为平面三角形。SO3溶于水生成H2SO4,H2SO4电离产生SO
=3,则SO3中的硫原子为sp2杂化,分子空间结构为平面三角形。SO3溶于水生成H2SO4,H2SO4电离产生SO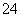 ,中心硫原子的价电子对数为
,中心硫原子的价电子对数为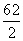 =4,故硫原子的杂化轨道类型为sp3杂化。
=4,故硫原子的杂化轨道类型为sp3杂化。
(4)氯气能够与NaOH溶液反应,离子方程式为Cl2+2OH-===ClO-+Cl-+H2O。
(5)合金中Na和Al的物质的量之比为1∶1,含1 mol Na的合金置于足量的水中发生的反应有:2Na+2H2O===2NaOH+H2↑、2NaOH+2Al+2H2O===2NaAlO2+3H2↑。故存在如下转化关系: Na~Al~2H2
1 mol 44.8 L。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
下表为某有机物分别与各种试剂反应的现象,则这种有机物可能是( )
| 试剂 | 钠 | 酸性高锰酸钾溶液 | NaHCO3溶液 |
| 现象 | 放出气体 | 褪色 | 不反应 |
A.CH2===CH—COOH B.CH2===CHCH3
C.CH3COOCH2CH3 D.CH2===CHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
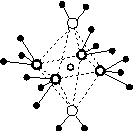
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素的核电荷数依次增大,属于周期表中前四周期的元素。其中A原子的核外有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F原子的M层电子排布式为________________。
(2)B、C、D的第一电离能由小到大的顺序为________________________________________________________________________
(用元素符号表示)。
(3)A的简单氢化物分子极易溶于水,其主要原因是____________________________________。
(4)E的最高价氧化物分子的空间构型是____________,其中心原子的杂化方式为__________。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为________。
(6)A、F形成的某种化合物的晶胞结构如图K348所示,则其化学式为________(黑色球表示F原子);已知紧邻的白球与黑球之间的距离为a cm,则该晶胞的密度为__________g/cm3。

图K348
查看答案和解析>>
科目:高中化学 来源: 题型:
电子层数相同的三种元素X、Y、Z,已知最高价氧化物对应水化物的酸性HXO4 、H2YO4、H3ZO4,则下列判断错误的是 ( )
A.原子半径X>Y>Z
B.气态氢化物的稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.气态氢化物的还原性HX<H2Y<ZH3
查看答案和解析>>
科目:高中化学 来源: 题型:
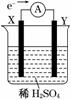 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁
C.X极上发生的是氧化反应,Y极上发生的是还原反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com