
| A、NaNO2在反应中被氧化 |
| B、NaI是还原产物 |
| C、若反应过程中转移2mole-,则生成标准状况下NO的体积为44.8L |
| D、氧化剂与还原剂之比为1:2 |
| 2mol |
| 1 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
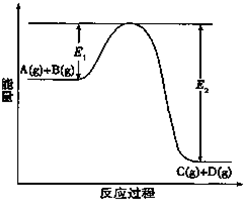 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化,只表现为热量的变化 |
| B、煤和石油属于可再生能源 |
| C、汽车排出大量尾气中含有CO会污染大气 |
| D、要使燃料燃烧只需要大量的氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸具有氧化性,无氧酸则不具有氧化性 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 7 |
| 2 |
| A、2△H1+2△H2-2△H3 3K1+2K2-2K3 | ||||||||
B、2△H3-3△H1-2△H2
| ||||||||
C、3△H1+2△H2-2△H3
| ||||||||
| D、3△H1+2△H2-2△H3 3K1+2K2-2K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com