
分析 (1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根据方程式或化合价的变化判断;
(2)根据反应物中某元素化合价的降低来分析氧化剂,酸性气体用碱性溶液吸收;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,反应的离子方程式为:As2S3+10H++10NO3-=2H3AsO4+3S↓+10NO2↑+2H2O,反应中As的化合价升高,N元素的化合价降低,原电池中得电子的物质在正极反应.
解答 解:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,
故答案为:1:1;
(2)反应中As2S3中的As元素化合价降低,As2S3为氧化剂,H2S为酸性气体,可用NaOH溶液吸收;
故答案为:As2S3;NaOH溶液;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,反应的离子方程式为:As2S3+10H++10NO3-=2H3AsO4+3S↓+10NO2↑+2H2O,反应中As的化合价升高,N元素的化合价降低,若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol,原电池中得电子的物质在正极反应,则硝酸根离子在正极得电子生成NO2,
故答案为:10mol;正极.
点评 本题考查了氧化还原反应,涉及了氧化还原反应的配平、氧化剂、氧化产物的判断及分析电子转移的数目,题目难度中等,侧重于考查学生的分析能力和计算能力.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
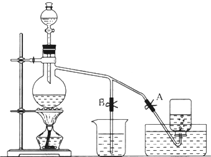 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| A | 基态原子2p能级有3个单电子 |
| B | 基态原子p轨道上成对电子数等于未成对电子数 |
| C | 氢化物常用于刻蚀玻璃 |
| D | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| E | 原子序数等于C与D的原子序数之和 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
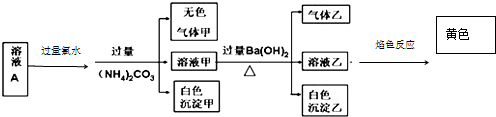
| A. | 沉淀乙一定可溶于盐酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定没有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 气体甲、乙均为无色、有刺激性气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com