
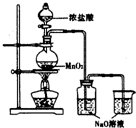
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
分析 制备家用消毒液,并探究其性质:装置A:盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,装置B:氯气和氢氧化钠反应:
Cl2+2NaOH═NaClO+NaCl+H2O,制得消毒液,氯气有毒,尾气需用氢氧化钠吸收.
(1)制备消毒液涉及反应为制取氯气,氯气和碱反应生成消毒液;
(2)同体积、同PH=13的溶液中,30min后褪色,而消毒液,5min后褪色,通过对比实验,得出此实验小组制备的消毒液具有漂白性;
(3)①操作b中溶液变成黄绿色为氯气,是因为氯离子、次氯酸根离子在酸性条件下发生氧化还原反应,生成氯气;
②用硫酸代替盐酸,据此判断是否为氯元素的价态归中生成氯气;
(4)①碘单质遇淀粉显示蓝色,根据滴定终点碘单质消耗,判断颜色变化;
②ClO-具有强氧化性,酸性条件下,将I-氧化为I2,自身被还有为Cl-,同时生成H2O,发生离子反应为:2I-+ClO-+2H+=I2+Cl-+H2O,结合2Na2S2O3+I2=Na2S4O6+2NaI,2H++ClO-+Cl-═Cl2↑+H2O,可得关系式2Cl2~2ClO-~2I2~4Na2S2O3,据此计算单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量,进而计算此消毒液有效氯含量.
解答 解:(1)消毒液的主要成分为次氯酸钠,利用上述装置制备消毒液,首先在装置A:盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,其次在装置B:氯气和氢氧化钠反应:Cl2+2NaOH═NaClO+NaCl+H2O,制得消毒液,
故答案为:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O;Cl2+2NaOH═NaClO+NaCl+H2O;
(2)酚酞在强碱性溶液中红色会褪去,但同样体积、同PH值的氢氧化钠溶液,滴加2滴酚酞溶液变红,30min后褪色,而消毒液,pH=13,溶液变红,5min后褪色,褪色时间短,说明此实验小组制备的消毒液具有漂白性,
故答案为:5mL pH=13;漂白性;
(3)①次氯酸根中氯为+1价,氯离子为-1价,在酸性条件下发生归中反应,生成氯气,反应为:2H++ClO-+Cl-═Cl2↑+H2O,黄绿色气体为氯气,
故答案为:2H++ClO-+Cl-═Cl2↑+H2O;
②操作b中溶液变成黄绿色,有同学认为氯元素的价态归中生成氯气结论并不严谨,需要进一步确认此结论,可由硫酸替代酸性条件,取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色,若没有,操作b获得上述结论严谨,
故答案为:取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色;
(4)①碘单质遇淀粉显示蓝色,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,溶液蓝色褪去且半分钟内不恢复,达到滴定终点,
故答案为:溶液蓝色褪去且半分钟恢复;
②ClO-具有强氧化性,酸性条件下,将I-氧化为I2,自身被还有为Cl-,同时生成H2O,发生离子反应为:2I-+ClO-+2H+=I2+Cl-+H2O,结合2Na2S2O3+I2=Na2S4O6+2NaI,可得关系式2ClO-~2I2~4Na2S2O3,有效氯指单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量,2H++ClO-+Cl-═Cl2↑+H2O,根据2ClO-~2Cl2~4Na2S2O3,$\frac{0.1mol/L×20×1{0}^{-3}L}{\frac{4}{5g}}$×2×71g/mol×100%=1.42%,
故答案为:1.42%.
点评 本题以消毒液考查物质的成分及含量的探究,明确物质的性质及发生的化学反应为解答的关键,注意计算中量的关系为解答的易错点,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵明矾中加入过量的氢氧化钡溶液的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol | |
| C. | 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ | |
| D. | 将过量SO2通入少量氨水中的离子方程式为:SO2+2NH3•H2O═2NH4++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
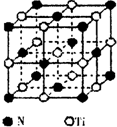 钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.
钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 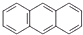 (蒽)和 (蒽)和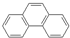 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 | |
| B. | 一般不能使用过酸的洗涤剂洗涤棉织品和丝织品,不能使用过碱的洗涤剂洗涤氨纶(聚氨基甲酸酯纤维)、腈纶(聚丙烯腈)等合成纤维制品 | |
| C. | 异黄酮类物质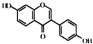 和酚类物质 和酚类物质 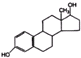 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) | |
| D. | 一定条件下将总质量相等的CH3OH、CH3COOH混合物或HCOOH、HOCOOCH2OH混合物在氧气中完全燃烧,燃烧后的全部产物通入足量过氧化钠层,过氧化钠层增加的质量之比为23:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 葡萄糖可用于补钙药物的合成 | |
| C. | 天然药物无任何毒副作用,可长期服用 | |
| D. | 超导陶瓷、高温结构陶瓷和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用规格为100mL的量筒量取89.7mL蒸馏水 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液前需用标准液润洗 | |
| C. | 打开分液漏斗、长颈漏斗、滴液漏斗的活塞,均可放出其中液体 | |
| D. | 锥形瓶、烧杯、烧瓶均可垫加石棉网加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | Fe2+(Fe3+),还原铁粉,过滤 | |
| C. | Cl2(HCl),饱和食盐水,洗气 | |
| D. | CO2(SO2),饱和NaHCO3溶液、浓硫酸,洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com