
【题目】(1)现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_____________________________;
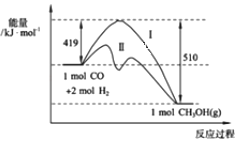
(2)已知该反应中相关的化学键键能数据如图所示,则C≡O中的键能为_____kJmol﹣1;图中曲线Ⅱ表示____________(填反应条件)的能量变化。
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)图中数字“419”表示的是_________________________;
(4)下列反应中,属于放热反应的是_______ (填编号,下同),属于吸热反应的是_______;
①物质燃烧;②炸药爆炸;③酸碱中和反应;④二氧化碳通过炽热的碳;⑤食物因氧化而腐败;⑥Ba(OH)28H2O与NH4Cl反应;⑦铁粉与稀盐酸反应。
【答案】CO(g)+2H2(g)=CH3OH(g)△H=﹣91kJ/mol 1084 使用催化剂 反应的活化能或1molCO和2molH2断键所需要吸收的能量 ①②③⑤⑦ ④⑥
【解析】
(1)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式;
(2)依据化学反应焓变=反应物键能总和-生成物键能总和计算C≡O中的键能,图中曲线Ⅱ表示降低了反应物的活化能,据此分析;
(3)根据图象分析判断数字“419”表示的含义;
(4)根据常见的放热反应和吸热反应分析判断。
(1)反应物的总能量与活化能的差值为419kJ,生成物的总能量与活化能的差值为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;
(2)焓变=反应物键能总和-生成物键能总和,所以设C≡O中的键能为xkJ/mol,则-91=436×2+x-(413×3+343+465),解得:x=1084kJ/mol,图中曲线Ⅱ表示降低了反应物的活化能,所以曲线Ⅱ表示使用了催化剂的能量变化;故答案为:1084;使用了催化剂;
(3)图中数字“419”表示的是反应的活化能或1molCO和2molH2断键所需要吸收的能量,故答案为:反应的活化能或1molCO和2molH2断键所需要吸收的能量;
(4)①物质燃烧属于放热反应;②炸药爆炸属于放热反应;③酸碱中和反应属于放热反应;④二氧化碳通过炽热的碳虽然是化合反应,但属于吸热反应;⑤食物因氧化而腐败属于放热反应;⑥Ba(OH)28H2O与NH4Cl反应为吸热反应 ⑦铁粉与稀盐酸的反应属于放热反应;所以放热反应有:①②③⑤⑦;吸热反应有:④⑥,故答案为:①②③⑤⑦;④⑥。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
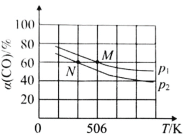
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列。按这种规定,下面说法正确的是( )
A. 最外层电子数为ns2的元素都在第2列
B. 第5列元素的原子最外层电子的排布式为![]()
C. 第10、11列为ds区的元素
D. 形成化合物种类最多的元素在第14列,属于P区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
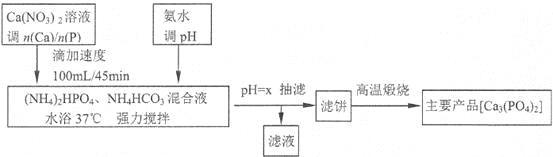
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
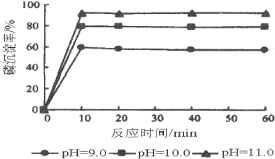
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B.Y的起始浓度不能为零,平衡浓度也不能为零
C.在其他条件不变的情况下,改变反应温度,平衡一定会发生移动
D.当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
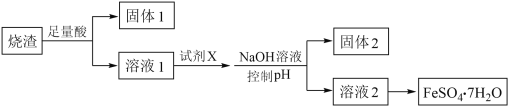
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是( )
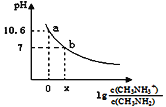
A.甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B.b点对应的加入盐酸的体积小于20mL
C.a点对应的溶液中c(CH3NH2)< c(CH3NH3+)
D.常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,著名记者柴静的雾霾调查纪录片![]() 穹顶之下
穹顶之下![]() ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
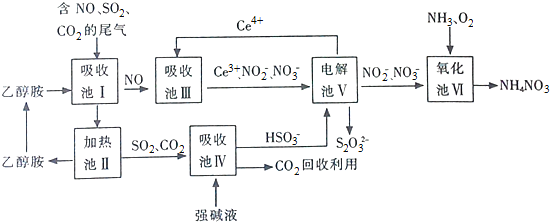
(1)上述流程中循环使用的物质有 ______ ,吸收池Ⅰ吸收的气体有 ______ .
(2)向吸收池Ⅳ得到的![]() 溶液中滴加
溶液中滴加![]() 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
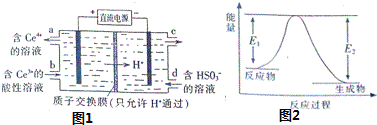
(3)电解池Ⅴ制得![]() 的原理如图1所示.
的原理如图1所示.
写出电解总反应的离子方程式 ______ .
(4)![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,![]() ,
,![]() .
.
已知:①![]()
②![]()
请写出NO与CO反应生成无污染气体的热化学方程式: ______ .
(5)上述流程中每一步均恰好完全反应,若制得![]() 质量为xkg,电解池V制得
质量为xkg,电解池V制得![]() 的
的![]() 溶液
溶液![]() ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的![]() 在标准状况下的体积为 ______
在标准状况下的体积为 ______ ![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com