
| A、“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
| D、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C、实验室常用粗锌和稀硫酸反应制取H2 |
| D、从海水中提取溴的过程涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
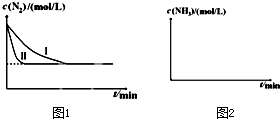
查看答案和解析>>
科目:高中化学 来源: 题型:
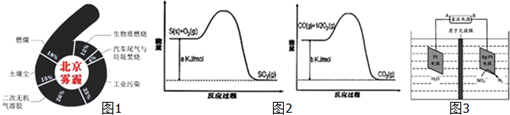
| 催化剂 |
| 180℃ |
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
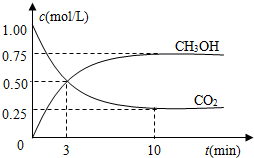 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体M能与水反应生成X单质和一种强碱 |
| B、Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C、Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D、M和N中均含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、Y2+的半径比T2-的半径大 |
| C、Z2R3不能在水溶液中存在 |
| D、元素X和T形成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com