
| A. | 3mL | B. | 10mL | C. | 15mL | D. | 27.5mL |
分析 n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量,据此分析解答.
解答 解:n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量;
由两者反应的离子方程式知Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O知,
当碱的量不足时,只发生反应Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
当碱过量时,生成氢氧化铝发生的反应为Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
根据铝离子守恒得n(AlO2-)=0.03mol-0.01mol=0.02mol,发生的反应为Al3++4OH-═AlO2-+2H2O,根据方程式知,生成偏铝酸根离子需要氢氧化钠体积=$\frac{0.02mol×4}{4mol/L}$=20mL,
所以一共需要氢氧化钠体积为7.5mL+20mL=27.5mL,
故选D.
点评 本题考查了物质的量的有关计算,明确氯化铝和氢氧化钠之间的反应是解本题关键,注意要分情况讨论,很多同学往往漏掉氢氧化钠溶液和氢氧化铝的反应而导致错误,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
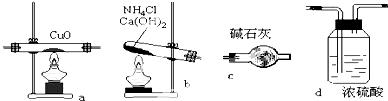 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子比钠原子少了一个质子 | |
| B. | 钠原子有还原性,钠离子有氧化性 | |
| C. | 钠原子和钠离子有相似的化学性质 | |
| D. | 钠原子不稳定,钠离子稳定,两者具有相同的电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
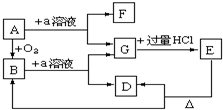 在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,F是最轻的气体单质,据此填写下列空白:
在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,F是最轻的气体单质,据此填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com