
| A. | 溶液的酸性逐渐增强 | B. | 铜片逐渐溶解 | ||
| C. | 溶液中H+向锌片作定向移动 | D. | 锌片是负极并被氧化 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极,阴离子移向正极,阳离子移向负极,据此分析判断.
解答 解:A.铜作正极,正极上氢离子得电子生成氢气,所以溶液中H+的物质的量浓度不断减小,溶液酸性逐渐减弱,故A错误;
B.铜为正极,锌为负极,锌逐渐溶解,铜的质量不变,故B错误
C.铜为正极,锌为负极,溶液中H+移向正极铜片,故C错误;
D.锌为负极,锌失去电子发生氧化反应,故D正确;
故选D.
点评 本题考查了原电池原理,题目难度不大,明确原电池工作原理为解答关键,注意掌握正负极的判断和电极方程式的书写方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大H2的浓度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | N2与H2能100%转化为NH3 | D. | 升高温度能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
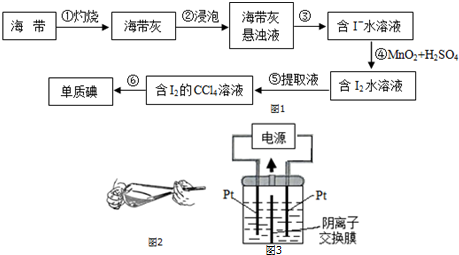
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: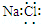 | |
| B. | 聚乙烯的结构简式: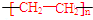 | |
| C. | 硫离子的结构示意图: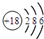 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | 氢化物的稳定性为H2E<H2D | |
| C. | B与E形成的化合物既能溶于盐酸又可溶于氢氧化钠溶液 | |
| D. | 最高价氧化物对应水化物碱性:B比A的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积分数75%的乙醇溶液常用于医疗消毒 | |
| B. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得各种烷烃、苯及其他衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com