
【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:
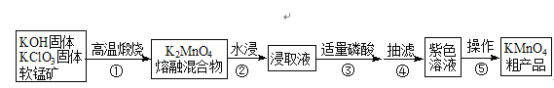
已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

【答案】高温下瓷坩埚和玻璃棒会与KOH等反应,与铁不反应 6KOH+KClO3+3MnO2![]() 3K2MnO4 +KCl+3H2O AD ABC dabef 滴入最后一滴标准液,溶液紫红色恰好褪去,且半分钟内不变色 88.00%
3K2MnO4 +KCl+3H2O AD ABC dabef 滴入最后一滴标准液,溶液紫红色恰好褪去,且半分钟内不变色 88.00%
【解析】
(1)高温下瓷坩埚和玻璃棒中的二氧化硅和KOH等反应,被腐蚀,而铁坩埚和铁棒不反应。
(2)①中每生成1molK2MnO4时电子转移2mol,则生成3molK2MnO4时电子转移6mol;每1molKClO3参加反应转移电子6mol,根得失电子守恒,则KClO3与K2MnO4的物质的量比为1:3,则此反应的化学反应方程式为6KOH+KClO3+3MnO2![]() 3K2MnO4 +KCl+3H2O。(3)根据表格中的数据CH3COOK和 K2CO3的溶解度比KMnO4大的多,蒸发浓缩基本上会留在母液中,其它的溶解度和KMnO4接近,会随KMnO4结晶析出。故BC不符合题意,AD符合题意。答案选AD。
3K2MnO4 +KCl+3H2O。(3)根据表格中的数据CH3COOK和 K2CO3的溶解度比KMnO4大的多,蒸发浓缩基本上会留在母液中,其它的溶解度和KMnO4接近,会随KMnO4结晶析出。故BC不符合题意,AD符合题意。答案选AD。
(4)A.操作⑤中蒸发至大量晶体析出,趁热过滤,防止出现大量的副产品,故A错误;
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸,故B正确。
C.不能用无水乙醇洗涤产品提高纯度,无水乙醇会与高锰酸钾反应,被高锰酸钾氧化,故C错误;
D.KMnO4受热易分解,KMnO4晶体的烘干温度过高会降低产率,应低温烘干,故D正确。(5)粗产品的洗涤步骤应为dabef的顺序排列。(6)高锰酸钾会与(NH4)2Fe(SO4)2发生氧化还原反应,当恰好反应时,高锰酸钾紫色刚好褪去,则滴定终点的现象为滴入最后一滴标准液,溶液紫红色恰好褪去,且半分钟内不变色;由图滴定前和滴定后的液面可知,滴定过程中消耗(NH4)2Fe(SO4)2溶液的体积为22.00mL。滴定过程中高锰酸钾和(NH4)2Fe(SO4)2发生氧化还原反应,高锰酸钾中锰元素价态由+7价降低到+2价生成Mn2+,(NH4)2Fe(SO4)2中Fe2+由+2价升高到+3价生成Fe3+,根据化合价升降守恒,高锰酸钾和(NH4)2Fe(SO4)2的物质的量比为1:5时恰好反应。过程中消耗n[(NH4)2Fe(SO4)2]=0.022L×0.1000molL﹣1=0.0022mol,则锥形瓶中25.00mL的高锰酸钾的物质的量为n(KMnO4)=0.0022mol÷5=0.00044mol,则250.00mL的高锰酸钾的物质的量0.0044mol,质量为m(KMnO4)=0.0044mol×158g/mol=0.6952g,则高锰酸钾的纯度为0.06952÷0.7900×100%=88.00%。
(1)高温下瓷坩埚和玻璃棒中的二氧化硅和KOH等反应,被腐蚀,而铁坩埚和铁棒不反应。本小题答案为:高温下瓷坩埚和玻璃棒会与KOH等反应,与铁不反应。
(2)①中每生成1molK2MnO4时电子转移2mol,则生成3molK2MnO4时电子转移6mol;每1molKClO3参加反应转移电子6mol,根得失电子守恒,则KClO3与K2MnO4的物质的量比为1:3,则此反应的化学反应方程式为6KOH+KClO3+3MnO2![]() 3K2MnO4 +KCl+3H2O。本小题答案为:6KOH+KClO3+3MnO2
3K2MnO4 +KCl+3H2O。本小题答案为:6KOH+KClO3+3MnO2![]() 3K2MnO4 +KCl+3H2O。
3K2MnO4 +KCl+3H2O。
(3)根据表格中数据CH3COOK和 K2CO3的溶解度比KMnO4大的多,蒸发浓缩基本上会留在母液中,其它的溶解度和KMnO4接近,会随KMnO4结晶析出。故BC不符合题意,AD符合题意。答案选AD。
(4)A.操作⑤中蒸发至大量晶体析出,趁热过滤,防止出现大量的副产品,故A错误;
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸,故B正确。
C.不能用无水乙醇洗涤产品提高纯度,无水乙醇会与高锰酸钾反应,被高锰酸钾氧化,故C错误;
D.KMnO4受热易分解,KMnO4晶体的烘干温度过高会降低产率,应低温烘干,故D正确。答案选AC。
(5)粗产品的洗涤步骤应为dabef的顺序排列。本小题答案为:dabef。
(6)高锰酸钾会与(NH4)2Fe(SO4)2发生氧化还原反应,当恰好反应时,高锰酸钾色刚好褪去,则滴定终点的现象为滴入最后一滴标准液,溶液紫红色恰好褪去,且半分钟内不变色;由图滴定前和滴定后的液面可知,滴定过程中消耗(NH4)2Fe(SO4)2溶液的体积为22.00mL。滴定过程中高锰酸钾和(NH4)2Fe(SO4)2发生氧化还原反应,高锰酸钾中锰元素价态由+7价降低到+2价生成Mn2+,(NH4)2Fe(SO4)2中Fe2+由+2价升高到+3价生成Fe3+,根据化合价升降守恒,高锰酸钾和(NH4)2Fe(SO4)2的物质的量比为1:5时恰好反应。过程中消耗n[(NH4)2Fe(SO4)2]=0.022L×0.1000molL﹣1=0.0022mol,则锥形瓶中25.00mL的高锰酸钾的物质的量为n(KMnO4)=0.0022mol÷5=0.00044mol,则250.00mL的高锰酸钾的物质的量0.0044mol,质量为m(KMnO4)=0.0044mol×158g/mol=0.6952g,则高锰酸钾的纯度为0.06952÷0.7900×100%=88.00%。本小题答案为:滴入最后一滴标准液,溶液紫红色恰好褪去,且半分钟内不变色;88.00%。


科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:

已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4ClO4可用作火箭燃料,130℃时会分解产生三种单质气体和水。实验室中通过NaClO4与NH4Cl反应来制取NH4ClO4,NH4ClO4与NaCl的溶解度如下图。下列说法正确的是( )

A. NH4ClO4分解后产生的气体通入紫色石蕊溶液中,溶液变红色
B. NH4ClO4分解后产生的气体通过足量NaOH溶液,再通过足量灼烧的铜网,可得到纯净的单质气体
C. NH4ClO4与NaCl的混合溶液分离时,应采取蒸发浓缩,冷却结晶,过滤,得到NH4ClO4固体粗产品
D. 在NH4ClO4固体粗产品中加入NaOH浓溶液,加热,收集所得NH3体积,可计算粗产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究浅黄色液体X(仅含三种常见元素)的组成和性质,设计并完成如下实验:
 请回答如下问题:
请回答如下问题:
(1)X的化学式是_________。
(2)X在过量氧气中燃烧的化学方程式是_________。
(3)溶液C滴在淀粉KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
(1)该反应的化学方程式为:_____________________;
(2)反应开始至2min,用X表示的平均反应速率为____________________________;
(3)反应开始至2min时,Y的转化率为__________;
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:________
②保持容器的体积不变,增加X的物质的量:________;
③保持容器的体积不变,增加He:________;
④增大容器的体积:________。
(5)下列叙述能说明上述反应一定达到化学平衡状态的是______(填序号)
A.X、Y、Z的物质的量之比为3:1:2
B.X、Y、Z的浓度不再发生变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.容器中的压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:

已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C. 恒温恒容下,增大压强,H2浓度一定减小
D. 该反应的焓变为正值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com