
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
考点: 阿伏加德罗常数.
分析: A.氯气参与反应时可能只做氧化剂被还原,也可能既做氧化剂又做还原剂,发生歧化反应;
B.NO2和N2O4的最简式是相同的,都是NO2,按照最简式计算;
C.溶液体积未知;
D.稀硫酸不会与铜反应.
解答: 解:A.氯气参与反应时可能只做氧化剂被还原,此时1mol氯气转移2mol电子;但氯气也可能既做氧化剂又做还原剂,发生歧化反应,如在与NaOH溶液的反应中:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气参与反应时转移1mol电子,故A错误;
B.NO2和N2O4的最简式是相同的,都是NO2,所以由6 g NO2和40 g N2O4组成的混合气体的氮原子和氧原子的物质的量分别是1mol和2mol,则原子总数约为3NA,故B正确;
C.溶液体积未知,无法计算HF和F﹣个数,故C错误;
D.随着反应的进行,硫酸的浓度变小,稀硫酸不会与铜反应,所以12.5mL16mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.1NA,故D错误;
故选:B.
点评: 本题考查了阿伏伽德罗常数,掌握公式的运用和物质的结构是关键,注意浓硫酸和铜的反应,铜足量,浓硫酸不会完全反应.


科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体:CO2+OH﹣=HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是含氮元素的化合物,有下列几个反应(未配平):
①A+O2→C ②C+H2O→A+B ③D+O2→A+H2O ④A+C+NaOH→E+H2O写出上述五种化合物的分子式:
A是 ,B是 ,C是 ,D是 ,E是
(2)某同学写出下面四个不同价态的氮的化合物相互转换的关系(未配平):
A.NO+HNO3→N2O3+H2O
B.NH3+NO→HNO2+H2O
C.N2O4+H2O→HNO3+HNO2
D.NH3+HNO2→N2+H2O
其中你认为一定不可能实现的是 (填字母编号).
查看答案和解析>>
科目:高中化学 来源: 题型:
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图所示,下列说法正确的是( )

|
| A. | 二茂铁中Fe2+与环戊二烯离子(C5H5﹣)之间为离子键 |
|
| B. | 1mol环戊二烯中含有σ键的数目为5NA |
|
| C. | 分子中存在π键 |
|
| D. | Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的原电池装置
(1)金属Zn组成的电极是 极,发生 反应,电极反应方程式为 ;
(2)金属Cu电极反应方程式为 .
(3)当导线上通过3.01×1022个电子时,锌片质量减少 g,铜片表面析出氢气 L(标准状况).

查看答案和解析>>
科目:高中化学 来源: 题型:
无水氯化铝是一种重要韵催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g)△H>0.下列分析错误的是()
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是()
A. 增大反应体系的压强,反应速率可能加快
B. 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C. 电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D. 将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是()
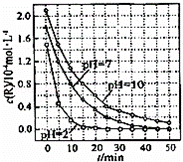
A. 在0﹣50min之间,pH=2和pH=7 时R的降解百分率相等
B. 溶液酸性越强,R 的降解速率越小
C. R的起始浓度越小,降解速率越大
D. 在 20﹣25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中不正确的是( )
|
| A. | 锂(Li)与水反应比钠与水反应剧烈 |
|
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 |
|
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
|
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是( )

|
| A. | 香叶醇的分子式为C10H18O |
|
| B. | 不能使溴的四氯化碳溶液褪色 |
|
| C. | 不能使酸性高锰酸钾溶液褪色 |
|
| D. | 能发生加成反应不能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com