
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
C
解析试题分析:还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为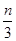 ,消耗碘离子的量为
,消耗碘离子的量为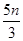 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-
。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-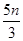 =2.5n,解得
=2.5n,解得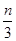 =
=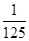 mol,所以消耗碘酸钾的物质的量是(
mol,所以消耗碘酸钾的物质的量是(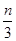 +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
+0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
考点:考查氧化还原反应的有关判断和计算


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:单选题
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在Cu2S+2Cu2O 6Cu+SO2↑反应中,说法正确的是
6Cu+SO2↑反应中,说法正确的是
| A.Cu2O在反应中被氧化 | B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 | D.若反应中转移12mol电子,则生成6molCu |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com