
| A. | 碳酸钙和盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钙溶液与盐酸溶液反应 HCO3-+H+=H2O+CO2↑ | |
| D. | 向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑ |
分析 A.碳酸钙难溶于水;
B.离子个数配比不符合物质的结构;
C.二者反应实质是氢离子与碳酸氢根离子反应生成水和二氧化碳;
D.Fe与盐酸反应生成氯化亚铁和氢气.
解答 解:A.碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,其反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.稀硫酸与氢氧化钡溶液反应,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.碳酸氢钙溶液与盐酸溶液反应,反应实质是氢离子与碳酸氢根离子反应生成水和二氧化碳,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故C正确;
D.Fe与盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,故D错误.
故选C.
点评 本题考查离子反应方程式书写的正误判断,题目难度不大,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意反应物用量对反应的影响.


科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
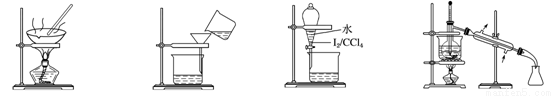
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
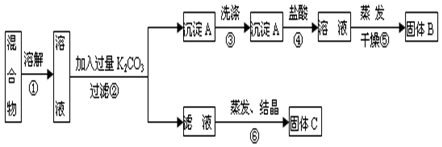
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
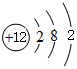 ,⑤
,⑤ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com