
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C. 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓
D. 向次氯酸钠溶液中通入SO2:2ClO+SO2+H2O=SO32-+2HClO
【答案】C
【解析】试题分析:A.盐酸是强酸,完全电离,浓盐酸要写离子形式,因此实验室用MnO2和浓盐酸制取Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,错误;B.Ca(HCO3)2溶液中加入少量NaOH溶液,要以不足量的NaOH为标准,离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O,错误;C. 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性,反应产生硫酸钡、硫酸钠和水,反应的离子方程式是:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓,正确;D. 向次氯酸钠溶液中通入SO2,由于SO2有还原性,次氯酸根离子有氧化性,会发生氧化还原反应,产生SO42-、Cl-,反应的离子方程式是:ClO-+H2O+ SO2= SO42-+2H++Cl-,错误。
Mn2++Cl2↑+2H2O,错误;B.Ca(HCO3)2溶液中加入少量NaOH溶液,要以不足量的NaOH为标准,离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O,错误;C. 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性,反应产生硫酸钡、硫酸钠和水,反应的离子方程式是:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓,正确;D. 向次氯酸钠溶液中通入SO2,由于SO2有还原性,次氯酸根离子有氧化性,会发生氧化还原反应,产生SO42-、Cl-,反应的离子方程式是:ClO-+H2O+ SO2= SO42-+2H++Cl-,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】指出下列反应中SiO2所表现的化学性质或作用,在A~E选项中选择正确答案填入括号内。
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C===Si+2CO↑
③SiO2+3C===SiC+2CO↑
④SiO2+4HF===SiF4↑+2H2O
a.作为玻璃的成分被消耗而使玻璃被腐蚀
b.氧化性
c.酸性氧化物的通性
d.未参加氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼,冶炼方法与其活泼性有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
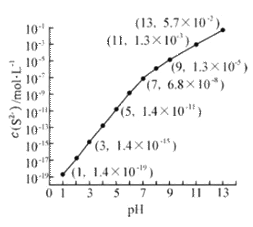
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(Q>0)
2SO3(g)(Q>0)
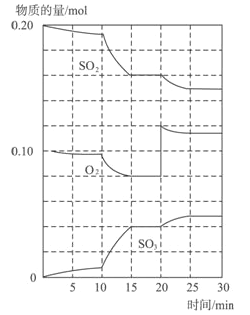
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要食品添加剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)查阅资料:①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。

实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 ;
(2)D装置的作用是 ;
(3)C中反应生成NaNO2的化学方程式是 ;
(4)检验C中产物有亚硝酸钠的正确操作是 (填序号) ;
a.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2
b.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2
(5)经检验C的产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称);
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 常温常压下,用铁和浓硫酸制取SO2气体
B. 用酸性高锰酸钾溶液鉴别环己烷和甲苯
C. 用饱和碳酸氢钠溶液除去O2中混有的少量HCl气体
D. 用分液漏斗分离苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当0.01mol氯化铬(III)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol氯化银沉淀析出,此样品的配离子的表示式为
A. [Cr(H2O)6]3+ B. [CrCl(H2O)5]2+ C. [CrCl2(H2O)4]+ D. [CrCl3(H2O)3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com