
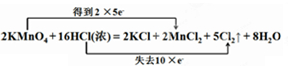
 ;
; ;
;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质和糖类的水解都是高分子生成小分子的过程 |
| B、甲苯分子中所有原子均处在同一个平面上 |
| C、溴水与乙烯发生加聚反应而褪色 |
| D、天然气和液化石油气的主要成分都是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则下列说法正确的组合是( )
A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则下列说法正确的组合是( )| A、①②③④ | B、②④ |
| C、①② | D、①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com