
”¾ĢāÄæ”æøł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
ČēĶ¼ĪŖŹµŃéŹŅijÅØĮņĖįŹŌ¼ĮĘæµÄ±źĒ©£¬ŹŌøł¾Ż±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż»Ų“šĻĀĮŠĪŹĢā£ŗ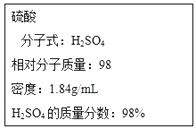
£Ø1£©øĆÅØĮņĖįÖŠH2SO4µÄĪļÖŹµÄĮæÅضČĪŖ
£Ø2£©Ä³Ń§ÉśÓūÓĆÉĻŹöÅØĮņĖįŗĶÕōĮóĖ®ÅäÖĘ250mLĪļÖŹµÄĮæÅضČĪŖ0.4molL©1µÄĻ”ĮņĖį£¬øĆѧɜŠčŅŖĮæČ”ÉĻŹöÅØĮņĖį½ųŠŠÅäÖĘ£®
£Ø3£©ĪŖÅäÖĘ£Ø2£©ÖŠµÄĻ”ĮņĖį£¬ĻĀĮŠæɹ©Ń”ÓƵÄŅĒĘ÷ÖŠ£¬Ņ»¶ØÓƵ½µÄŹĒ£ØĢī±ąŗÅ£©£¬ÅäÖĘ¹ż³ĢÖŠ»¹Č±ÉŁµÄŅĒĘ÷ŹĒ£ØĢīŠ“ŅĒĘ÷Ćū³Ę£©
¢Ł²£Į§°ō£»¢Ś½ŗĶ·µĪ¹Ü£»¢ŪĮæĶ²£»¢ÜŅ©³×£»¢ŻŌ²µ×ÉÕĘ棻¢ŽĢģĘ½£»¢ßÉÕ±£»¢ąĘÕĶØĀ©¶·
£Ø4£©Č”ÉĻŹöÅäÖĘŗƵÄĮņĖįČÜŅŗ50mLÓė×ćĮæµÄĀĮ·“Ó¦£¬ĖłµĆČÜŅŗÖŠc£ØAl3+£©=£ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©£¬¼ģŃéČÜŅŗÖŠSO42©“ęŌŚµÄ·½·Ø£ŗ
”¾“š°ø”æ
£Ø1£©18.4mol/L
£Ø2£©5.4mL
£Ø3£©¢Ł¢Ś¢Ū¢ß£»250mLČŻĮæĘæ
£Ø4£©![]() mol/L£»Č”ÉŁĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42©
mol/L£»Č”ÉŁĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42©
”¾½āĪö”æ½ā£ŗ£Ø1£©ÅØĮņĖįµÄĪļÖŹµÄĮæÅضČ= ![]() =
= ![]() mol/L=18.4mol/L£¬
mol/L=18.4mol/L£¬
¹Ź“š°øĪŖ£ŗ18.4mol/L£»£Ø2£©ÅØĮņĖįĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±ä£¬ÅØĮņĖįĢå»ż= ![]() =5.4mL£¬
=5.4mL£¬
¹Ź“š°øĪŖ£ŗ5.4mL£»£Ø3£©ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅضČĮņĖįČÜŅŗŠčŅŖµÄŅĒĘ÷ÓŠ£ŗÉÕ±”¢²£Į§°ō”¢250mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü”¢ĮæĶ²£¬ĖłŅŌŠčŅŖµÄŅĒĘ÷ÓŠ¢Ł¢Ś¢Ū¢ß£¬»¹ŠčŅŖ250mLČŻĮæĘ棬
¹Ź“š°øĪŖ£ŗ¢Ł¢Ś¢Ū¢ß£»250mLČŻĮæĘ棻£Ø4£©ĮņĖįŗĶAl·“Ӧɜ³ÉĮņĖįĀĮ£¬øł¾ŻSO42©ŹŲŗćµĆc[Al2£ØSO4£©3]= ![]() c£ØH2SO4£©£¬ĮņĖįĀĮÖŠĀĮĄė×ÓŗĶĮņĖįøłĄė×ÓÅضČĪŖ2£ŗ3£¬ĖłŅŌc£ØAl3+£©=2c[Al2£ØSO4£©3]=2”Į
c£ØH2SO4£©£¬ĮņĖįĀĮÖŠĀĮĄė×ÓŗĶĮņĖįøłĄė×ÓÅضČĪŖ2£ŗ3£¬ĖłŅŌc£ØAl3+£©=2c[Al2£ØSO4£©3]=2”Į ![]() c£ØH2SO4£©=
c£ØH2SO4£©= ![]() ”Į0.4mol/L=
”Į0.4mol/L= ![]() mol/L£»ĮņĖįøłĄė×ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ¼ģŃ飬Ęä¼ģŃé·½·ØĪŖȔɣĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42© £¬
mol/L£»ĮņĖįøłĄė×ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ¼ģŃ飬Ęä¼ģŃé·½·ØĪŖȔɣĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42© £¬
¹Ź“š°øĪŖ£ŗ ![]() mol/L£»Č”ÉŁĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42© £®
mol/L£»Č”ÉŁĮæŹŌŅŗ£¬ĻņĘäÖŠµĪČėŃĪĖį£¬ĪŽĻÖĻó£¬ŌŁ¼ÓĀČ»Æ±µČÜŅŗ³öĻÖ°×É«³Įµķ£¬¼““ęŌŚSO42© £®
£Ø1£©ÅØĮņĖįµÄĪļÖŹµÄĮæÅضČ= ![]() £»£Ø2£©ÅØĮņĖįĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±ä£¬¾Ż“Ė¼ĘĖćÅØĮņĖįĢå»ż£»£Ø3£©ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅضČĮņĖįČÜŅŗŠčŅŖµÄŅĒĘ÷ÓŠ£ŗÉÕ±”¢²£Į§°ō”¢250mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü”¢ĮæĶ²£»£Ø4£©ĮņĖįŗĶAl·“Ӧɜ³ÉĮņĖįĀĮ£¬øł¾ŻĮņĖįøłĄė×ÓŹŲŗć¼°ĮņĖįøłĄė×ÓŗĶĀĮĄė×Ó¹ŲĻµ¼ĘĖćĀĮĪļÖŹµÄĮæÅØ¶Č£»ĮņĖįøłĄė×ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ¼ģŃ飮
£»£Ø2£©ÅØĮņĖįĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±ä£¬¾Ż“Ė¼ĘĖćÅØĮņĖįĢå»ż£»£Ø3£©ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅضČĮņĖįČÜŅŗŠčŅŖµÄŅĒĘ÷ÓŠ£ŗÉÕ±”¢²£Į§°ō”¢250mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü”¢ĮæĶ²£»£Ø4£©ĮņĖįŗĶAl·“Ӧɜ³ÉĮņĖįĀĮ£¬øł¾ŻĮņĖįøłĄė×ÓŹŲŗć¼°ĮņĖįøłĄė×ÓŗĶĀĮĄė×Ó¹ŲĻµ¼ĘĖćĀĮĪļÖŹµÄĮæÅØ¶Č£»ĮņĖįøłĄė×ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ¼ģŃ飮


 Ņ»ĻßĆūŹ¦ĢįÓÅŹŌ¾ķĻµĮŠ“š°ø
Ņ»ĻßĆūŹ¦ĢįÓÅŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠĖłŗ¬»Æѧ¼üĄąŠĶÓėĘäĖūČżÖÖĪļÖŹ²»Ņ»ÖĀµÄŹĒ
A.N2B.H2OC.NaClD.CO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£²ĪŌıķÖŠŹż¾Ż£¬ĻĀĮŠÅŠ¶ĻŌŚ±ź×¼×“æöĻĀÕżČ·µÄŹĒ
NO2 | HF | |
ČŪµć/”ę | -11.2 | -83.6 |
·Šµć/”ę | 21.0 | 19.52 |
A. 2.0gHFÖŠŗ¬µē×ÓŹżÄæĪŖl.0NA
B. 12gŹÆÄ«Ļ©(µ„²ćŹÆÄ«)ÖŠŗ¬ÓŠĮłŌŖ»·øöŹżĪŖNA
C. 6.72LNO2ÓėĖ®·“Ó¦ŗó£¬×ŖŅʵĵē×ÓŹżĪŖ0.2NA
D. NOŗĶO2ø÷2.24L³ä·Ö·“Ó¦ŗóĖłµĆ»ģŗĻĪļĢåĻµÖŠŗ¬·Ö×ÓŹżĪŖ0.1NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦ŌŚÉś²ś”¢Éś»īÖŠÓ¦ÓĆ¹ć·ŗ£¬ÓĆĖłŃ§ÖŖŹ¶»Ų“šĪŹĢā£ŗ
£Ø1£©ÖŲøõĖįļ§[£ØNH4£©2Cr2O7]ŹÜČČ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ĻĀĮŠø÷×éÖŲøõĖįļ§ŹÜČČ·Ö½ā²śĪļµÄÅŠ¶Ļ·ūŗĻŹµ¼ŹµÄŹĒ
A.CrO3+NH3+H2O
B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O
D.Cr2O3+N2+H2O
£Ø2£©Č”300mL 0.2mol/LµÄKIČÜŅŗÓėŅ»¶ØĮæµÄĖįŠŌKMnO4ČÜŅŗĒ”ŗĆ·“Ó¦£¬Éś³ÉµČĪļÖŹµÄĮæµÄI2ŗĶKIO3 £¬ KMnO4±»»¹Ō³ÉMn2+ £¬ øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½
£Ø3£©KClO3ŗĶÅØŃĪĖįŌŚŅ»¶ØĪĀ¶ČĻĀ·“Ó¦»įÉś³É»ĘĀĢÉ«µÄŅ×±¬Īļ¶žŃõ»ÆĀČ£®Ęä±ä»ÆæɱķŹöĪŖ£ŗ2KClO3+4HCl£ØÅØ£©ØT2KCl+2ClO2”ü+Cl2”ü+2H2O£®
a£®Ēė·ÖĪöøĆ·“Ó¦ÖŠµē×Ó×ŖŅʵÄĒéæö£Øµ„ĻßĒŷرķŹ¾£©£ŗ £®
B£®»¹Ō¼ĮÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ £®
c£®ÅØŃĪĖįŌŚ·“Ó¦ÖŠĻŌŹ¾³öĄ“µÄŠŌÖŹŹĒ £® £ØĢīŠ“±ąŗÅ£©
¢ŁÖ»ÓŠ»¹ŌŠŌ£»¢Ś»¹ŌŠŌŗĶĖįŠŌ£»¢ŪÖ»ÓŠŃõ»ÆŠŌ£»¢ÜŃõ»ÆŠŌŗĶĖįŠŌ£®
d£®²śÉś0.1mol Cl2 £¬ Ōņ×ŖŅʵĵē×ÓµÄĪļÖŹµÄĮæĪŖmol£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśÓĆĮæĶ²Č”ŅŗĢåŹ±£¬ĮæĶ²Ę½ĪȵŲ·ÅÖĆŌŚŹµŃéĢØÉĻ£¬¶ųĒŅĆę¶ŌæĢ¶ČĻߣ¬³õ“ĪŃöŹÓŅŗĆę¶ĮŹżĪŖ18ŗĮÉż£¬µ¹³ö²æ·ÖŅŗĢåŗó£¬ø©ŹÓŅŗĆę¶ĮŹżĪŖ12ŗĮÉż£¬ŌņøĆѧɜŹµ¼Źµ¹³öµÄŅŗĢåĢå»żĪŖ£Ø£©
A. “óÓŚ6ŗĮÉż B. Š”ÓŚ6ŗĮÉż C. µČÓŚ6ŗĮÉż D. æÉÄÜ“óÓŚŅ²æÉÄÜŠ”ÓŚ6ŗĮÉż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ź×¼×“æöĻĀµÄ1.5 molH2µÄĢå»żŌ¼ĪŖ
A.11.2 LB.22.4 LC.33.6 LD.44.8 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫40”ęµÄ±„ŗĶĮņĖįĶČÜŅŗÉżĪĀÖĮ50”ę£¬»ņÕßĪĀ¶ČČŌ±£³ÖŌŚ40”ę¶ų¼ÓČėÉŁĮæĪŽĖ®ĮņĖįĶ£¬ŌŚÕāĮ½ÖÖĒéæöĻĀ¾ł±£³Ö²»±äµÄŹĒ
A. ĮņĖįĶµÄČܽā¶ČB. ČÜŅŗµÄÖŹĮæ
C. ČÜŅŗÖŠČÜÖŹµÄÖŹĮæ·ÖŹżD. ČÜŅŗÖŠCu2+µÄŹżÄæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶعżČܽā”¢¹żĀĖ”¢Õō·¢µČ²Ł×÷£¬æɽ«ĻĀĮŠø÷×é»ģŗĻĪļ·ÖĄėµÄŹĒ(””””)
A. ĻõĖįÄĘ”¢ĒāŃõ»ÆÄĘ B. Ńõ»ÆĶ”¢¶žŃõ»ÆĆĢ
C. ĀČ»Æ¼Ų”¢Ģ¼ĖįøĘ D. ĮņĖįĶ”¢ĒāŃõ»ÆÄĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°Ń4molAŗĶ2.5molB»ģŗĻÓŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗ3A(g)+2B(s)![]() xC(g)+D(g)£¬5minŗó·“Ó¦“ļµ½Ę½ŗā£¬ČŻĘ÷ÄŚŃ¹Ēæ±äŠ”£¬²āµĆDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.05mol”¤L-1”¤min-1£¬“ķĪóµÄŹĒ
xC(g)+D(g)£¬5minŗó·“Ó¦“ļµ½Ę½ŗā£¬ČŻĘ÷ÄŚŃ¹Ēæ±äŠ”£¬²āµĆDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.05mol”¤L-1”¤min-1£¬“ķĪóµÄŹĒ
A. AµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.15mol”¤L-1”¤min-1 B. Ę½ŗāŹ±£¬CµÄÅضČĪŖ0.25 mol”¤L-1
C. BµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.1mol”¤L-1”¤min-1 D. Ę½ŗāŹ±£¬ČŻĘ÷ÄŚŃ¹ĒæĪŖŌĄ“µÄ0.875±¶
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com