
| A. | 钠的熔点较低 | B. | 钠的密度较小 | ||
| C. | 钠的失电子能力较强 | D. | 钠的导电性 |
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
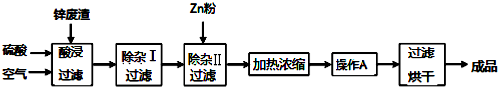
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的化学性质 | |
| B. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| C. | 高分子材料可能在特殊情况导电,如聚乙炔 | |
| D. | 可用作荧光灯内壁保护层的纳米氧化铝属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
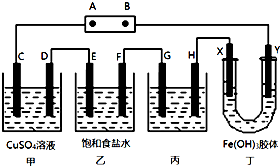 某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
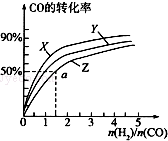 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com