
| A. | 最易失去的电子能量最高 | |
| B. | 电离能最小的电子能量最高 | |
| C. | 2p轨道电子能量高于2s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最高 |
分析 A.根据原子核外电子能量与距核远近的关系判断;
B.根据电离能的定义判断;
C.同一层p轨道电子能量高于s轨道电子;
D.根据电子首先进入能量最低、离核最近的轨道判断.
解答 解:A.能量越高的电子在离核越远的区域内运动,也就越容易失去,故A正确;
B.电离能是失去电子时所要吸收的能量,能量越高的电子在失去时消耗的能量也就越少,因而电离能也就越低,故B正确;
C.同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,故C正确;
D.电子首先进入能量最低、离核最近的轨道,在离核最近区域内运动的电子能量最低,故D错误.
故选D.
点评 本题考查原子核外电子排布规律,题目难度不大,本题注意原子核外电子的排布和运动特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>KCl>NaCl | D. | CaO>BaO>NaCl>KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.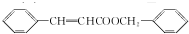 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
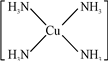 2+.
2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
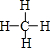 .
.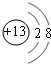 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 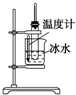 实验室制取少量的硝基苯 | |
| B. | 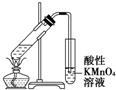 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 | |
| C. | 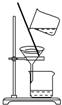 分离乙酸乙酯、碳酸钠和水的混合物 | |
| D. | 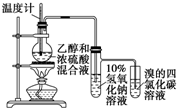 证明乙醇、浓硫酸共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯中一个氢原子被氯原子取代,有机产物有3种 | |
| B. | 苯环上的一氯取代物的同分异构体有2种 | |
| C. | C5H12的一氯代物有8种 | |
| D. | C7H8O含苯环的同分异构体有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com