
| c[Ni(CO)4] |
| c(CO) |


| [Ni(CO)4] |
| [CO]4 |
| c[Ni(CO)4] |
| c(CO) |
| [Ni(CO)4] |
| [CO]4 |
| △C |
| △t |
| ||
| 3s |


科目:高中化学 来源: 题型:
| A、①③④ | B、①②③ |
| C、①③⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时储氢合金作正极 |
| B、放电时负极反应为:LaNi5H6-6e-═LaNi5+6H+ |
| C、充电时阳极周围c(OH-)减小 |
| D、充电时储氢合金作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
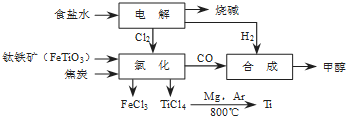
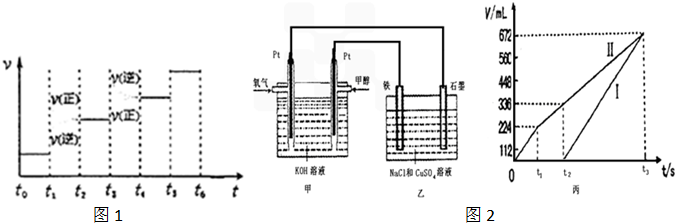
查看答案和解析>>
科目:高中化学 来源: 题型:
 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:查看答案和解析>>
科目:高中化学 来源: 题型:
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18g H2O含有2NA个O-H键 |
| B、1L 1mol/L Na2CO3溶液中含有NA个CO32- |
| C、1mol Al被完全氧化生成Al2O3,转移6NA个电子 |
| D、常温下,22.4L的N2和O2混合气体,含有2NA个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com