
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是()
A. CH![]() C-CH3B.
C-CH3B. ![]() C. CH2=CHCH3D.
C. CH2=CHCH3D. 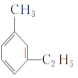
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15. 2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道排布图为___________。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____晶体,其电子式为____________。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为______________ (标明配位键)
(4)AlH4-中,Al的轨道杂化方式为_______;例举与AlH4-空间构型相同的两种离子_________(填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有______个;NaAlH4晶体的密度为______________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列叙述正确的是( )
A.含1mol乙酸的溶液中H+数等于0.1NA
B.标准状况下,22.4L乙醇的分子数为NA
C.28g乙烯和丙烯所含碳氢键的数目为4NA
D.1 mol甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见气态单质在适当条件下可发生如图所示的转化,其中B和C均为10电子分子。下列有关判断不正确的是

A.Y元素位于第二周期VA族
B.A与C能发生氧化还原反应
C.X的最简单氢化物的热稳定性比Y的强
D.Y的最简单氢化物与其最高价氧化物对应的水化物溶液反应,所得溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
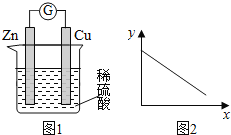
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出上述反应的平衡常数表达式______。
(2)①结合表中数据,判断该反应的ΔH____0(填“>”或“<”),理由是_____
②判断该反应达到平衡的依据是_____。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
II.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是____。
、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK___NaClO,两溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com