
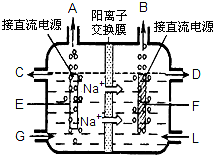
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
| ||
| ||
| ||


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.3 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | ||
| 平衡浓度/mol?L-1 | 0.1 |
| A、0~2min的平均速率v(X)=0.01mol?L-1?min-1 |
| B、达平衡时Y的转化率为50% |
| C、其它条件不变,升高温度,平衡逆向移动 |
| D、其它条件不变,增加X的浓度,v正增大v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
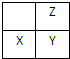 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
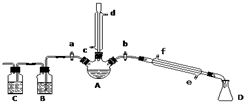 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:查看答案和解析>>
科目:高中化学 来源: 题型:
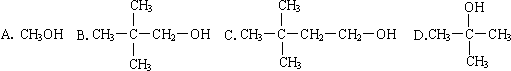
查看答案和解析>>
科目:高中化学 来源: 题型:
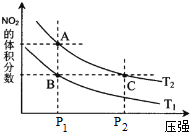
| c(H2)c(CO) |
| c(H2O) |
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
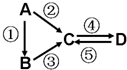 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
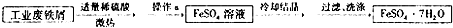
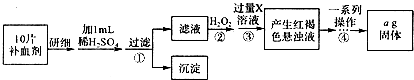
查看答案和解析>>
科目:高中化学 来源: 题型:
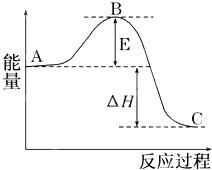 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com