
 ?
?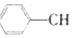 =CH2��g��+H2��g��
=CH2��g��+H2��g��| ʱ��/min | 0 | 10 | 20 | 30 | 40 |
| n���ұ���/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n������ϩ��/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A�� | ���������������䣬�������г��벻���뷴Ӧ��ˮ������Ϊϡ�ͼ������ұ���ת���ʴ���50.0% | |
| B�� | ��Ӧ��ǰ20���ӵ�ƽ������Ϊv��H2��=0.008molmol/�� L•min�� | |
| C�� | ����������ƽ��Ħ���������ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬ | |
| D�� | ��ͬ�¶��£���ʼʱ�������г���0.10mol�ұ���0.10mol����ϩ��0.30molH2���ﵽƽ��ǰv����v�� |
���� A�����������������䣬�������г��벻���뷴Ӧ��ˮ������Ϊϡ�ͼ�����Ӧ������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����ұ���ת���ʲ��䣬���ݱ������ݼ����ұ���ת���ʣ�
B���ɱ������ݿ�֪��20min���ұ������ʵ����仯��Ϊ0.4mol-0.24mol=0.16mol������v=$\frac{\frac{��n}{V}}{��t}$����v���ұ������ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��H2����
C����Ӧǰ���������������䣬����������ʵ��������仯����ƽ��Ħ������Ϊ������
D����������ʽƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ���������ʱ��Ũ����Qc����ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���з��ݴ˽��
��� �⣺A���ɱ������ݿ�֪��30minʱ����ƽ��״̬��ƽ��ʱ����ϩ�����ʵ���Ϊ0.2mol���ɷ���ʽ��֪���μӷ�Ӧ���ұ������ʵ���Ϊ0.2mol�����ұ���ת����Ϊ��$\frac{0.2mol}{0.4mol}$��100%=50%�����������������䣬�������г��벻���뷴Ӧ��ˮ������Ϊϡ�ͼ�����Ӧ������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����ұ���ת���ʲ���Ϊ50%����A����
B���ɱ������ݿ�֪��20min���ұ������ʵ����仯��Ϊ0.4mol-0.24mol=0.16mol����v���ұ���=$\frac{\frac{0.16mol}{2L}}{20min}$=0.004mol•L-1•min-1������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=v���ұ���=0.004mol•L-1•min-1����B����
C���÷�Ӧǰ���������������䣬����������ʵ���Ϊ����������M=$\frac{m}{n}$��֪����ƽ��Ħ������Ϊ����������������ƽ��Ħ���������ٱ仯����˵�����淴Ӧ������ȣ��÷�Ӧ�Ѵﵽƽ��״̬����C����ȷ
D���ɱ������ݿ�֪��30minʱ����ƽ��״̬��ƽ��ʱ����ϩ�����ʵ���Ϊ0.2mol��ƽ��ʱ����ϩ��Ũ��Ϊ$\frac{0.2mol}{2L}$=0.1mol/L���ɷ���ʽ��֪��������ƽ��Ũ��Ϊ0.1mol/L���μӷ�Ӧ���ұ������ʵ���Ϊ0.2mol����ƽ��ʱ�ұ���Ũ��Ϊ0.1mol/L����ƽ�ⳣ��k=$\frac{0.1��0.1}{0.1}$=0.1����ͬ�¶��£���ʼʱ�������г���0.10mol�ұ���0.10mol����ϩ��0.30molH2����ʱŨ����Qc=$\frac{\frac{0.1}{2}��\frac{0.3}{2}}{\frac{0.1}{2}}$=0.15������ƽ�ⳣ��0.1����Ӧ���淴Ӧ���У��ʴﵽƽ��ǰv����v������D����
��ѡC��
���� ���⿼�黯ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰��ѧ��Ӧ���ʼ��㡢��ѧƽ���йؼ��㡢��ѧƽ�ⳣ��������Ӧ�õ�֪ʶ����ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ���ע��Dѡ��������ƽ�ⳣ���жϷ�Ӧ���з���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2��g��+3H2��g��?2NH3��g����H��0 | B�� | 2HI��g��?H2��g��+I2��g����H��0 | ||
| C�� | 4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H��0 | D�� | C��s��+H2O��g��?H2��g��+CO��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��طŵ�ʱ����ظ�����Χ��Һ��c��OH-��Ϊ������ | |
| B�� | ��طŵ�ʱ��H2�Ǹ��� | |
| C�� | ��ط�ʱʱ����Ԫ�ر����� | |
| D�� | ��طŵ�ʱ����Ԫ�ر����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
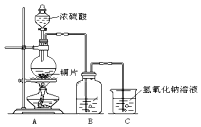 ��ͼΪ����ͭ��Ũ���ᷴӦ��װ�ã���ش�
��ͼΪ����ͭ��Ũ���ᷴӦ��װ�ã���ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| W | X | Y |
| Z |
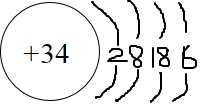 ��
��| ��� | �����Ʋ� | ��ѧ����ʽ |
| ʾ�� | ������ | H2ZO3+4HI�TZ��+2I2+1H2O |
| �� | ���� | H2SeO3+2NaOH=Na2SeO3+2H2O |
| �� | ��ԭ�� | H2SeO3+Cl2+H2O=H2SeO4+2HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
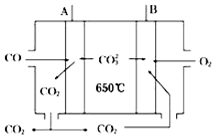 ����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�
����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
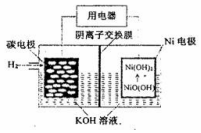
| A�� | �ŵ�ʱ��OH-��̼�缫Ǩ�� | |
| B�� | �ŵ�ʱ��������ӦNiO��OH��+H2O+e-=Ni��OH��2+OH- | |
| C�� | ���ʱ�����缫��缫���������� | |
| D�� | ���ʱ��̼�缫����ҺpH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.24 mol/��L•min�� | B�� | 0.08 mol/��L•min�� | C�� | 0.06 mol/��L•min�� | D�� | 0.12 mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com