
| A. | 分馏石油时的温度计 | B. | 制备氢气的简易装置中的长颈漏斗 | ||
| C. | 制备氯气装置中的分液漏斗 | D. | 制备乙酸乙酯时冷凝蒸气的导管 |
分析 A、分馏石油时的温度计,因测量的是蒸气的温度,所以不需插入液面以下;
B、制备氢气的简易装置中加入稀酸用的长颈漏斗应该起到液封的作用;
C、制备氯气装置中的分液漏斗,分液漏斗能用活塞控制;
D、制乙酸乙酯时注意防止倒吸.
解答 解:A、分馏石油时,因测量的是蒸气的温度,温度计下端需插在蒸馏烧瓶的支管口处以,不需插入液面以下,故A错误;
B、制备氢气的简易装置中加入稀酸用的长颈漏斗应该起到液封的作用,所以长颈漏斗要伸入液面下,故B正确;
C、制备氯气装置中的分液漏斗,分液漏斗能用活塞控制,所以分液漏斗不用插入液面下,故C错误;
D、制乙酸乙酯时注意防止倒吸,则导管下端不能插入到液面以下,故D错误.
故选B.
点评 本题考查较为综合,涉及温度计和其它仪器的放置位置,根据其实验目的及物质的性质确定仪器的位置为解答的关键,注意对知识点归纳总结,题目难度中等.


科目:高中化学 来源: 题型:解答题

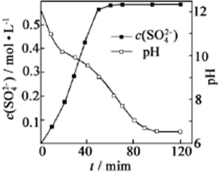
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| B. | 对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m<n | |
| C. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| D. | 25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氧氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 向水中通入氯气:Cl2+H2O?2H++Cl-+ClO- | |
| C. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2Na2O2═4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CuCl2+2 NaOH═Cu(OH)2↓+2NaCl | ||
| C. | FeO+2 HCl═FeCl2+H2O | D. | 2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH+4 | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氯化铵溶液与氢氧化钠溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应::Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜的阳极泥中可回收金、银等贵金属 | |
| B. | 废旧金属是一种固体废弃物,会污染环境 | |
| C. | 废旧金属的回收利用,即能防止环境污染,又能缓解资源短缺矛盾 | |
| D. | 废旧金属回收利用的成本比从矿石中冶炼出等量的金属成本高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的HCl为1.4mol | B. | 转移电子数1.806×1023 | ||
| C. | 氧化产物为0.4mol | D. | 还原剂占参加反应HCl的$\frac{3}{7}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com