
参考下表中物质的熔点,回答有关 问题:
问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤素离子及碱金属离子的________有关,随着________的增大,熔点依次降低。
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与________有关,随着________增大,________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为_______________,
故前者的熔点远高于后者。
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是( )
A.明矾水解的离子方程式:Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
B.CaCO3(s)=CaO(s)+CO2(g) △S>0
C.用纯碱溶液洗涤餐 具的原因,用离子方程式表示:CO32-+2H2O
具的原因,用离子方程式表示:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.BaSO4悬浊液中存在平衡:BaSO4(s)  Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
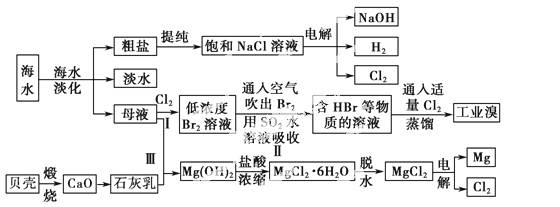
(1)在粗盐中含有Ca2+、Mg2+、SO等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是____________(填编号)。
(2)工业上电解饱和食盐水的离子方程式:_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________ _____。
_____。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_____________________。
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入________溶液,充分搅拌后经________(填操作方法)可得纯 净的Mg(OH)2。
净的Mg(OH)2。
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2·6H2O的原因:______________________。
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填序号)。
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
美国科学家理查德·海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。一种由废催化剂制取氯化钯的工艺流程如下:
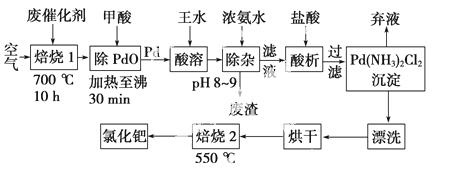
(1)废钯催化剂经烘干后,再在700 ℃的高温下焙烧,焙烧过程中需通入足量空气的原因是________________________________________________________________________;
甲酸还原氧化钯的化学方程式为____________________ ______________________。
______________________。
(2)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______________________。
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为__________、__________、__________。

(4)加浓氨水时,钯转变为可溶性[Pd(NH3)2]2+,此时铁的存在形式是________________________________________________________________________(写化学式)。
(5)700 ℃焙烧1的目的是________________;550 ℃焙烧2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于工业发 展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的
展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的 SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
(1)写出两个工业生产过程中产生SO2的实例:
①________________________________________________________________________、
②________________________________________________________________________。
(2)防治SO2污染可采用的措施有(写出三种):
①________________________________________________________________________、
②________________________________________________________________________、
③___________________ _____________________________________________________。
_____________________________________________________。
(3)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气 液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:________________________________________________________________________
_____________ ___________________________________________________________。
___________________________________________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是__________________。
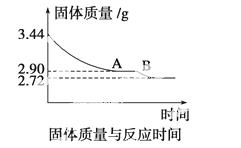
(4)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72 g后不再改变。求:
①石膏的化学式。②图像中AB段对应化合物的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
早期发 现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成
现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成 。回答下列问题:
。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾检验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化 亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
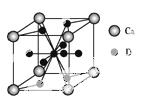
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。A原子L层的成对电子数和未成对电子数相等,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是 (用对应的元素符号表示);基态D原子的电子排布式为 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取 杂化;B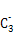 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。
(3)1 mol AB-中含有的π键个数为 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10- 23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:(a) Ni2+ + H2PO2-+ →  Ni++ H2PO3-+
Ni++ H2PO3-+
请在答题卡上写出并配平反应式(a)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,与12 g H2的体积相等的O2 ( )
A.质量为32 g B.物质的量为6 mol
C.约含有6×6.02×1023个氧原子 D.物质的量为12 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com