
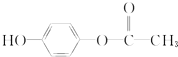
 分别与足量的NaOH溶液反应,耗碱量由多到少的顺序正确的是( )
分别与足量的NaOH溶液反应,耗碱量由多到少的顺序正确的是( )| A、②⑤④③① |
| B、④②③⑤① |
| C、④②⑤③① |
| D、④⑤②③① |


科目:高中化学 来源: 题型:

| NH3?H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
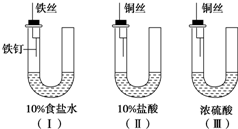 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S在纯氧中燃烧可生成SO3 |
| B、用澄清石灰水可鉴别CO2和SO2 |
| C、SO2能使KMnO4溶液褪色 |
| D、CO2通入CaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验序号 | 起始温度t1/℃ | 终止温度t1/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com