
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
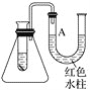
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
【答案】Mg+2H+===Mg2++H2↑ 镁片溶解,有气泡产生 下降 反应放出的热量使锥形瓶内气压增大 放热 小于
【解析】
根据离子反应方程式书写规则分析解答;根据常见化学实验基础操作及注意事项分析解答;
(1)镁和盐酸反应生成氯化镁和氢气,离子方程式为:Mg+2H+===Mg2++H2↑,所以能观察到镁片溶解,同时有气体生成;
故答案为:Mg+2H+===Mg2++H2↑,镁片溶解,有气泡产生;
(2)镁片与盐酸的反应是放热反应,是由于反应物的总能量高于生成物的总能量,放出的热量使锥形瓶内气压增大,导致U形管左端液面下降,右端液面上升;
故答案为:下降;反应放出的热量使锥形瓶内气压增大;放热;小于。


科目:高中化学 来源: 题型:
【题目】关于以下物质熔点比较正确的是( )
A.NaCl>金刚石>S>Hg
B.金刚石>NaCl>S>Hg
C.NaCl>金刚石>Hg>S
D.金刚石>NaCl>Hg>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,某小组利用下列装置制备NaClO2,并对其样品进行分析,查阅资料知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时析出NaClO2会分解。
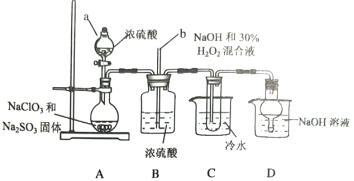
(1)仪器a的名称是__________;长玻璃导管b的作用是__________;装置D的作用是__________。
(2)装置A用于制备ClO2,理论上所加NaClO3和Na2SO3固体的物质的量之比是__________。
装置C中发生的离子方程式是__________。
(3)为提取NaClO2固体,试管中产品需蒸发结晶、过滤、洗涤,洗涤用水的温度范围是__________。
(4)称取Wg的产品配成250mL溶液,取25.00mL溶液,加足量KI和稀H2SO4,以①__________溶液作指示剂,用cmol·L-1Na2S2O3标准液滴定至终点(I2+2S2O32-=2I-+S4O62-),判断滴定终点的现象是②_________;若消耗标准溶液体积的平均值是VmL,则产品中NaClO2的质量分数是③__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
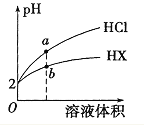
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定的终点时不慎少加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
A.4B.7.2C.10D.11.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应太慢。为了加快该反应的化学反应速率且不改变H2的产量,可以使用如下方法中的( )
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加NaOH固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10 mL 0.1 mol·L-1盐酸
A. ①⑥⑦ B. ②③⑥⑦ C. ③⑥⑦ D. ④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则( )
A. 锌电极为负极 B. 锌电极为正极
C. 电子从铜电极流向锌电极 D. 反应中Zn被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
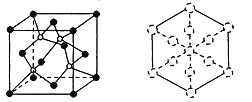
③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P原子的投影),用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com