
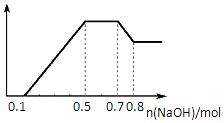
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含CO32-,可能含有SO42- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
分析 若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-.结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(NH4+),据此分析.
解答 解:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-;
A.由以上分析得溶液中一定不含CO32-,一定含有SO42-,故A错误;
B.根据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,根据第二段是氢氧化钠与铵根反应得到一水合氨的阶段,即NH4++OH-=NH3•H2O,消耗氢氧化钠的物质的量为0.7mol-0.5mol=0.2mol,所以溶液中n(NH4+)=0.2mol,故B正确;
C.据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,故C错误;
D.根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH-~[Al(OH)4]-,则消耗氢氧化钠的物质的量为:0.8mol-0.7mol=0.1mol,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH-~Al(OH)3,Mg2+~2OH-~Mg(OH)2,0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol-0.1mol-0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+):n(Al3+):n(Mg2+)=0.1:0.1:0.05=2:2:1,故D错误.
故选B.
点评 本题考查了离子的检验和有关离子方程式的计算,明确图象中各段发生的反应是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 宇宙飞船外壳 |  光导纤维 |  宇航服 |  尿不湿 |
| 酚醛树脂 | 二氧化硅 | 聚酯纤维 | 聚丙烯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需NaOH的质量 | 需要NaOH的质量为4.0g |
| (2)称量NaOH固体 | 称量过程中主要用到的仪器是 托盘天平、药匙 |
| (3)将NaOH加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 搅拌、加热、研细氢氧化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②④⑦ | C. | ①②⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有少量蒸馏水 | |
| B. | 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯 | |
| C. | 定容时观察液面时俯视定容 | |
| D. | 配溶液的Na2CO3•10H2O晶体在空气中久置风化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | ||
| Y | ||
| Z |
| A. | Z一定是活泼的金属 | |
| B. | Y的最高化合价为+7价 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质与足量水反应时,有2mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子均不存在化学键 | |
| B. | 共价化合物中一定含有共价键,也可能含有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键,也可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g苯所含碳碳双键数目为0.3NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com