
【题目】某温度下,体积一定的密闭容器中进行反应:![]()
![]() 。下列分析正确的是
。下列分析正确的是
A. 平衡后加入![]() ,该反应的
,该反应的![]() 增大
增大
B. 平衡后升高温度,平衡常数K变大
C. 平衡后再充入![]() ,达到新平衡时,
,达到新平衡时, ![]() 的百分含量变大
的百分含量变大
D. 若反应前充入的![]() 与
与![]() 物质的量相等,达平衡时
物质的量相等,达平衡时![]() 的转化率比
的转化率比![]() 的高
的高
科目:高中化学 来源: 题型:
【题目】下列实验操作均要使用玻璃棒,其中玻璃棒作用相同的是( )
①过滤;②蒸发;③溶解;④向容量瓶中转移液体.
A.①和④
B.①和③
C.③和④
D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y棒变细,则X、Y和Z溶液可能是下列中的( )
编号 | X | Y | Z溶液 |
|
A | Zn | Cu | 稀硫酸 | |
B | Cu | Zn | 稀硫酸 | |
C | Cu | Ag | 硫酸铜溶液 | |
D | Ag | Zn | 硝酸银溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室常用排饱和食盐水的方法收集氯气
B. 在硫酸亚铁溶液中,加入铁粉以防止氧化
C. 酯在碱性条件下水解的程度较为完全
D. 氨水应密闭保存,放置低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在![]() 的密闭容器中发生反应:
的密闭容器中发生反应:![]() ,当加入
,当加入![]() 和
和![]() 达平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入
达平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入![]() ,再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
,再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2 B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1 D. 第二次平衡时,Z的浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
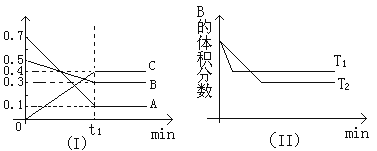
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·mim-1
B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生 产MnO2和Zn的工艺简化流程如图所示(中间产物的固体部分已经略去):
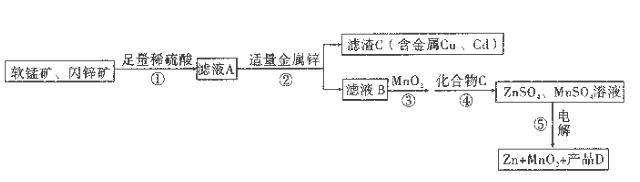
软锰矿: MnO2含量≥65%;Al2O3含量为4%。闪锌矿: ZnS含量≥80%; FeS、CuS、CdS含量各为2%。 滤液B中含金属离子: Zn2+、Mn2+、 Fe2+、Al3+。
试回答下列问题:
(1)步骤①中软锰矿、闪锌矿与硫酸溶液共热时可析出硫,且金属元素转化为相应的硫酸盐(铁元素以+3价存在)。 其中MnO2和FeS发生的离子方程式为___________________________。
(2)步骤③ 中的MnO2也可用下列___________________物质代替(不考虑Mn2+的反应)
A.KMnO4 固体 B.H2O2 C.浓硝酸 D.新制氯水
(3) 步骤⑤电解过程中阳极的电极反应式为___________________________。
(4)加入化合物C后可得纯净的ZnSO4 、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn (OH)2 或MnCO3,
则产品D为___________________________(填化学式)。
(5)I .将制得的MnO2(s)与KOH(s)、KClO3(s)(按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物;
II.再用5%的KOH溶液溶解得绿色(MnO42-)溶液;
III.向绿色溶液中通入适量的CO2后,将溶液加热,并趁热滤去残渣( 含MnO2(s)];
IV.将滤液蒸发浓缩、冷却结品、过滤、洗涤、干燥得紫色KMnO4晶体。
①第III步操作中“趁热过滤”的目的是___________________________。
② 写出III中生成KMnO4的化学程式__________________________________。
③III中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是



甲 乙 丙
A. 图甲中纯水仅升高温度,就可以从a点变到c点
B. 图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C. 图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L,C1-、Br-及I-的混合溶液,由图丙曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com