
分析 (1)工业上用电解饱和食盐水的方法获取氯气,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子,得电子的微粒发生还原反应;根据转移电子与氯气之间的关系式计算生成氯气体积;
(2)海水呈弱碱性,氯气在海水中发生副反应Cl2+OH-=ClO-+Cl-+H2O,加入硫酸能抑制氯气反应;
在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和BrO3-,同时有CO2生成,该反应中溴和碳酸钠是反应物,溴酸钠、溴化钠和二氧化碳是产物,根据反应物和产物书写方程式;
(3)氯气能氧化溴离子生成溴单质,然后采用分液方法分离提纯;
(4)同一主族的非金属元素,随着原子序数增大,原子核外电子层数增多,原子核对最外层电子的吸引力减小,导致其单质的氧化性减弱.
解答 解:(1)工业上用电解饱和食盐水的方法获取氯气,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子,所以阴极电极反应式为H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),得电子的微粒发生还原反应,所以该电极上发生还原反应;生成1mol氯气转移2mol电子,则转移5mol电子生成2.5mol氯气,其体积=2.5mol×22.4L/mol=56L,
故答案为:H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);还原;56;
(2)海水呈弱碱性,氯气在海水中发生副反应Cl2+OH-=ClO-+Cl-+H2O,加入的硫酸能氢氧根离子反应而抑制氯气反应,所以加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率;
在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和BrO3-,同时有CO2生成,该反应中溴和碳酸钠是反应物,溴酸钠、溴化钠和二氧化碳是产物,根据反应物和产物书写方程式为3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,
故答案为:海水呈弱碱性,氯气在海水中发生副反应Cl2+OH-→ClO-+Cl-+H2O,造成损耗.加入硫酸可中和海水的弱碱性避免副反应发生;3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑;
(3)氯气能氧化溴离子生成溴单质,然后采用分液方法分离提纯,所以其除杂方法为加入溴化钠溶液,搅拌,静置,分液,
故答案为:加入溴化钠溶液,搅拌,静置,分液;
(4)同一主族的非金属元素,随着原子序数增大,原子核外电子层数增多,原子核对最外层电子的吸引力减小,导致其单质的氧化性减弱,氯和碘处于同一主族,原子最外层都有7个电子,由于碘原子电子层数比氯多,原子核对最外层电子吸引力弱,所以碘得电子能力弱,单质的氧化性比氯弱,无法将铁元素氧化到+3价,
故答案为:氯和碘处于同一主族,原子最外层都有7个电子,由于碘原子电子层数比氯多,原子核对最外层电子吸引力弱,所以碘得电子能力弱,单质的氧化性比氯弱,无法将铁元素氧化到+3价.
点评 本题考查较综合,涉及电解原理、氧化还原反应、除杂、元素周期律等知识点,侧重考查学生分析、知识综合运用能力,明确化学反应原理、元素化合物性质、元素周期律等知识点是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.2 mol•L-1NH4CI溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
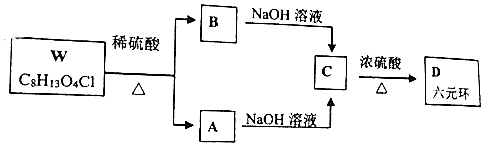
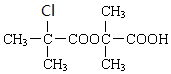 +H2O$→_{△}^{浓硫酸}$
+H2O$→_{△}^{浓硫酸}$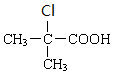 +
+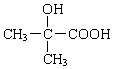 .
.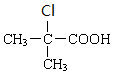 +2NaOH→
+2NaOH→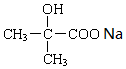 +2NaCl+H2O.
+2NaCl+H2O.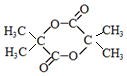 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 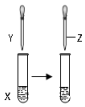 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 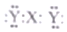 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷沸点高 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com