
�����й���ҺpH��˵����ȷ����(����)
| A����pH=11������������Һ��ˮϡ��100������Һ��c(H+)=10-13mol/L |
| B����pH=9������������Һ��pH=13������������Һ�������ϣ����û����Һ��pH=11 |
| C����pH=1��������Һ��pH=5������������ϣ����û����Һ��pH=1.3 |
| D��pH=13������������Һ��pH=1������������ϣ�������������������������Һ��pH>7 |
C
�������������pH=11������������Һ��ˮϡ��100����pH=9,������Һ��c(H+)=10-9mol/L����A����pH=9������������Һ��c(OH-)=10-5mol/L����pH=13������������Һ��c(OH-)=10-1mol/L����������Ϻ��c(OH-)=��10-5+10-1��/2��0.05��
����c(H+)=10-14/0.05=2��10-13mol/L������pH=-lgc(H+)=12.7����B����pH=1��������Һ�У�c(H+)=10-1mol/L��pH=5�������У�c(H+)=10-5mol/L����������Ϻ��c(H+)=��10-5+10-1��/2��0.05��pH=-lgc(H+)=1.3����C��ȷ��pH=13������������Һ��pH=1������������ϣ����������պ���������ȫ��Ӧ������������Һ��pHΪ7����D����
���㣺��ҺpH
���������⿼����ҺpH�ļ��㣬��һ�����ۺ��ԣ�������һ�����Ѷȡ�


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��14�֣�ʹ���ǹؽ�������������������ʯΪ������һ�༲�����ؽ���ԭ�������ڹؽڻ�Һ���γ��������ƣ�NaUr�����壬�й�ƽ�����£�
�� HUr(����,aq) Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
��NaUr(s) Ur-(aq)+ Na+(aq)
��1��37��ʱ,0.5 Lˮ�п��ܽ�4.0��10-3mol�����ƣ����¶��������Ƶ�KspΪ �� ��
��2���ؽ��������ڽ�ֺ����ָ�Ĺؽڴ�����˵���¶Ƚ���ʱ����Ӧ�ڵ�Ksp �� �����������С�����䡱�������������ƾ���ķ�Ӧ�� �� ������ȡ������ȡ�����Ӧ��
��3��37��ʱ��ij������Һ��������Ӻ���������ӵ���Ũ��Ϊ2.0��10-3 mol��L��1������������ӵ�Ũ��Ϊ4.0��10-4 mol��L��1���ò�����Һ��pHΪ �� ��
��4�������£���0.2 mol��L��1��HUr��Һ��0.1mol��L��1 NaOH��Һ�������ϣ������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ���� �� ��
A��c(HUr) > c(Ur��) B��pH > 7
C��c(Na+)��c(HUr)+c(Ur��) D��2 c(H+)��2 c��OH������[c(Ur��) ��c(HUr)]
��5���Ը�����ѧƽ��֪ʶ˵��һ�ַ��ιؽ��Ĵ�ʩ �� ��
��6����֪��ͼ��ʾt1ʱ���������Ƶı�����Һ��������㣩�м�����ˮ��������V�ܽ���V������ʱ���ϵ��ʾ��ͼ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ̨���и�����ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��14�֣�ʹ���ǹؽ�������������������ʯΪ������һ�༲�����ؽ���ԭ�������ڹؽڻ�Һ���γ��������ƣ�NaUr�����壬�й�ƽ�����£�
�� HUr(����,aq)  Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
��NaUr(s)  Ur-(aq) + Na+(aq)
Ur-(aq) + Na+(aq)
��1��37��ʱ,0.5 Lˮ�п��ܽ�4.0��10-3 mol�����ƣ����¶��������Ƶ�KspΪ �� ��
��2���ؽ��������ڽ�ֺ����ָ�Ĺؽڴ�����˵���¶Ƚ���ʱ����Ӧ�ڵ�Ksp �� �����������С�����䡱�������������ƾ���ķ�Ӧ�� �� ������ȡ������ȡ�����Ӧ��
��3��37��ʱ��ij������Һ��������Ӻ���������ӵ���Ũ��Ϊ2.0��10-3 mol��L��1������������ӵ�Ũ��Ϊ4.0��10-4 mol��L��1���ò�����Һ��pHΪ �� ��
��4�������£���0.2 mol��L��1��HUr��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ���� �� ��
| A��c(HUr) > c(Ur��) | B��pH > 7 |
| C��c(Na+)��c(HUr)+c(Ur��) | D��2 c(H+)��2 c��OH������[c(Ur��) ��c(HUr)] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ̨���и�����ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��14�֣�ʹ���ǹؽ�������������������ʯΪ������һ�༲�����ؽ���ԭ�������ڹؽڻ�Һ���γ��������ƣ�NaUr�����壬�й�ƽ�����£�
�� HUr(����,aq)  Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
��NaUr(s)  Ur-(aq)
+ Na+(aq)
Ur-(aq)
+ Na+(aq)
��1��37��ʱ,0.5 Lˮ�п��ܽ�4.0��10-3 mol�����ƣ����¶��������Ƶ�KspΪ �� ��
��2���ؽ��������ڽ�ֺ����ָ�Ĺؽڴ�����˵���¶Ƚ���ʱ����Ӧ�ڵ�Ksp �� �����������С�����䡱�������������ƾ���ķ�Ӧ�� �� ������ȡ������ȡ�����Ӧ��
��3��37��ʱ��ij������Һ��������Ӻ���������ӵ���Ũ��Ϊ2.0��10-3 mol��L��1������������ӵ�Ũ��Ϊ4.0��10-4 mol��L��1���ò�����Һ��pHΪ �� ��
��4�������£���0.2 mol��L��1��HUr��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ���� �� ��
A��c(HUr) > c(Ur��) B��pH > 7
C��c(Na+)��c(HUr)+c(Ur��) D��2 c(H+)��2 c��OH������[c(Ur��) ��c(HUr)]
��5���Ը�����ѧƽ��֪ʶ˵��һ�ַ��ιؽ��Ĵ�ʩ �� ��
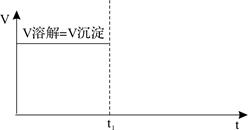
��6����֪��ͼ��ʾt1ʱ���������Ƶı�����Һ��������㣩�м�����ˮ��������V�ܽ���V������ʱ���ϵ��ʾ��ͼ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʹ���ǹؽ�������������������ʯΪ������һ�༲�����ؽ���ԭ�������ڹؽڻ�Һ���γ��������ƣ�NaUr�����壬�й�ƽ�����£�
�� HUr(����,aq) ![]() Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
Ur-(�����,aq) + H+(aq) ��37��ʱ��Ka =4.0��10-6��
��NaUr(s) ![]() Ur-(aq) + Na+(aq)
Ur-(aq) + Na+(aq)
��1��37��ʱ,0.5 Lˮ�п��ܽ�4.0��10-3 mol�����ƣ����¶��������Ƶ�KspΪ �� ��
��2���ؽ��������ڽ�ֺ����ָ�Ĺؽڴ�����˵���¶Ƚ���ʱ����Ӧ�ڵ�Ksp �� �����������С�����䡱�������������ƾ���ķ�Ӧ�� �� ������ȡ������ȡ�����Ӧ��
��3��37��ʱ��ij������Һ��������Ӻ���������ӵ���Ũ��Ϊ2.0��10-3 mol��L��1������������ӵ�Ũ��Ϊ4.0��10-4 mol��L��1���ò�����Һ��pHΪ �� ��
��4�������£���0.2 mol��L��1��HUr��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ���� �� ��
A��c(HUr) > c(Ur��) B��pH > 7
C��c(Na+)��c(HUr)+c(Ur��) D��2 c(H+)��2 c��OH������[c(Ur��) ��c(HUr)]
��5���Ը�����ѧƽ��֪ʶ˵��һ�ַ��ιؽ��Ĵ�ʩ �� ��
��6����֪��ͼ��ʾt1ʱ���������Ƶı�����Һ��������㣩�м�����ˮ��������V�ܽ���V������ʱ���ϵ��ʾ��ͼ

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com