
【题目】下图是元素周期表的一部分:
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | ⑧ | ||||||||||||||
Fe | |||||||||||||||||
Ⅰ.用化学用语回答下列问题:
(1)①、②、⑥形成的化合物中存在的化学键类型有________。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。
(3)写出②的离子结构示意图为__________。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。Y的水溶液与洁厕灵混合使用会产生一种有毒气体,该反应的离子方程式为_______。
Ⅱ.A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
![]()
(1)若A是一种金属单质,C是淡黄色固体,写出C的一种用途_____;
(2)若A、B、C均为化合物且含有同一种金属元素,D是会造成温室效应的一种气体,请写出D的电子式_____,A和C反应的离子方程式 ___。
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________。
【答案】离子键、共价键 HClO4>H2SO4>H2CO3 ![]() ClO-+Cl-+2H+=Cl2↑+H2O 强氧化剂或供氧剂
ClO-+Cl-+2H+=Cl2↑+H2O 强氧化剂或供氧剂 ![]() HCO3-+OH-=CO32-+ H2O 先加KSCN,无现象,后滴加氯水,溶液呈血红色 2Fe2++H2O2+2H+=2Fe3++2H2O
HCO3-+OH-=CO32-+ H2O 先加KSCN,无现象,后滴加氯水,溶液呈血红色 2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】
由表中元素所在的位置,可确定①、②、③、④、⑤、⑥、⑦、⑧分别为H、Na、Al、C、N、O、S、Cl元素。
Ⅰ.(1)①、②、⑥形成的化合物为NaOH,由此可确定其中存在的化学键为离子键、共价键;
(2)④、⑦、⑧的最高价含氧酸分别为H2CO3、H2SO4、HClO4,非金属性Cl>S>C,则酸性由强到弱的顺序为HClO4>H2SO4>H2CO3;
(3)②的离子为Na+,其原子核外有2个电子层,最外层达8电子稳定结构,则其离子结构示意图为![]() ;
;
(4)Y为NaClO,其水溶液与洁厕灵(HCl)混合使用会产生一种有毒气体Cl2,由此可写出该反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O;
Ⅱ.(1)C是淡黄色固体,则其为Na2O2,它的用途为强氧化剂或供氧剂;
(2)D是会造成温室效应的一种气体,则其为CO2,电子式为![]() ,A为NaOH,C为NaHCO3,则NaOH和NaHCO3反应的离子方程式为HCO3-+OH-=CO32-+ H2O;
,A为NaOH,C为NaHCO3,则NaOH和NaHCO3反应的离子方程式为HCO3-+OH-=CO32-+ H2O;
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,则其为Fe。A为Cl2,B为FeCl3,C为FeCl2。检验FeCl2中Fe2+的方法是先加KSCN,无现象,后滴加氯水,溶液呈血红色;在酸性溶液中Fe2+能被双氧水氧化,生成Fe3+、H2O,该反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
C.0.1 mol·L-1Na2SO3溶液:NH4+、K+、ClO-、Cl-
D.0.1 mol·L-1 FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
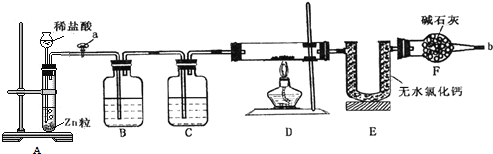
(1)实验前如何检验装置A的气密性________________________________________;
(2)为了实验安全,在点燃酒精灯前,在F装置出口b处必须_____________________;
(3)装置C中盛装的液体是浓硫酸,则装置B的作用是_________________________;
(4)U形管E右边又连接干燥管F的目的是___________。
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U形管的质量增加7.2 g,则混合物中Fe2O3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以扑热息痛(对乙酰氨基苯酚)为原料,经多步反应制甘素的流程如下:
AcHNOH扑热息痛![]() 非那西汀
非那西汀![]() …
…![]() 甘素
甘素

步骤Ⅰ:非那西汀的合成
①将含有1.0 g扑热息痛的药片捣碎,转移至双颈烧瓶中。用滴管加入8 mL 1 mol/LNaOH的95%乙醇溶液。开启冷凝水,随后将烧瓶浸入油浴锅。搅拌,达沸点后继续回流15 min。
②将烧瓶移出油浴。如图所示,用注射器取1.0 mL的碘乙烷,逐滴加入热溶液中。继续将烧瓶置于油浴回流15 min。
③将烧瓶从油浴中抬起,取下冷凝管趁热用砂芯漏斗抽滤,滤去不溶的淀粉(药片的填充物)。将热滤液静置,得到沉淀。用另一个砂芯漏斗过滤得到非那西汀固体。
步骤Ⅱ:甘素的合成
①将非那西汀固体转移到圆底烧瓶中,加入5 mL 6 mol/L盐酸。加热回流15 min。
②加入NaHCO3调至pH为6.0~6.5,再向反应液中加1.37 g尿素和2滴乙酸。加热回流60 min。
③移出烧瓶,冷却,有沉淀析出,抽滤,用冰水洗涤,得到甘素。
(1)将药片捣碎所用的仪器名称为________________。
(2)实验中用油浴加热的优点是______________________。
(3)使用砂芯漏斗抽滤的优点是_________________且得到的沉淀较干燥。
(4)冷凝管的冷却水从________(填“a”或“b”)端进。
(5)步骤Ⅱ中向热溶液中加入NaHCO3中和,为避免大量CO2逸出,加入NaHCO3时应__________________。
(6)用冰水洗涤甘素固体的操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应不仅有物质变化,同时还伴随着能量的变化,化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____。
(2)已知已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g液态水时放出的热量是__________ kJ(结果保留两位小数)
(3)已知热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol,2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
①现有H2和C3H8的混合气体共5mol,完全燃烧时放热3472.9kJ,则混合气体中H2和C3H8的体积比为__________。
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热_________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法不正确的是
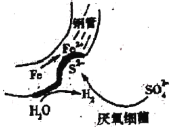
A.正极的电极反应式为:2H2O+2e-=H2+2OH-
B.SO42-与H2的反应可表示为:4H2+SO42- S2-+4H2O
S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)3
D.在钢管表面镀锌可减缓钢管的腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com