
【题目】一定温度下,在三个体积均为0.5L的密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中5 min时到达平衡。下列说法中正确的是
COCl2(g),其中容器Ⅰ中5 min时到达平衡。下列说法中正确的是
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.32 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO 0.8 mol、Cl20.8 mol,达到平衡时CO转化率大于80%
【答案】AC
【解析】A.容器I中前5min的平均反应速率v(COCl2)=  =0.32mol/Lmin-1,依据速率之比等于计量系数之比,则V(CO)=V(COCl2)=0.32mol/Lmin-1,故A正确;B.依据图中数据可知:Ⅱ和Ⅲ为等效平衡,升高温度,COCl2物质的量减小,说明平衡向逆向移动,则逆向为吸热反应,正向为放热反应,故B错误;
=0.32mol/Lmin-1,依据速率之比等于计量系数之比,则V(CO)=V(COCl2)=0.32mol/Lmin-1,故A正确;B.依据图中数据可知:Ⅱ和Ⅲ为等效平衡,升高温度,COCl2物质的量减小,说明平衡向逆向移动,则逆向为吸热反应,正向为放热反应,故B错误;
C. CO(g)+Cl2(g)COCl2(g),
起始浓度(mol/L) 2 2 0
转化浓度(mol/L)1.61.6 1.6
平衡浓度(mol/L)0.40.4 1.6
反应平衡常数K=![]() =10,平衡时CO转化率:
=10,平衡时CO转化率: ![]() ×100%=80%;依据Ⅱ中数据,结合方程式可知:
×100%=80%;依据Ⅱ中数据,结合方程式可知:
CO(g)+Cl2(g)COCl2(g),
起始浓度(mol/L) 2 2a 0
转化浓度(mol/L)1 1 1
平衡浓度(mol/L)1 2a-1 1
Ⅰ和Ⅱ温度相同则平衡常数相同则:K=![]() =10,解得:a=0.55mol,故C正确;D.CO(g)+Cl2(g)COCl2(g)为气体体积减小的反应,若起始时向容器I加入CO0.8mol,Cl20.8mol,相当于给体现减压,减压平衡向系数大的方向移动,平衡转化率降低,小于80%,故D错误;故选AC。
=10,解得:a=0.55mol,故C正确;D.CO(g)+Cl2(g)COCl2(g)为气体体积减小的反应,若起始时向容器I加入CO0.8mol,Cl20.8mol,相当于给体现减压,减压平衡向系数大的方向移动,平衡转化率降低,小于80%,故D错误;故选AC。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则物质C中所含化学键类型为 , 反应④的化学方程式为;
(2)若A是常见的金属单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是;检验E物质中阳离子的操作和现象 , A单质与1mol/L稀硝酸160mL恰好反应,最多消耗A单质g;
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据①~⑩元素的编号所在周期表中的位置,用化.学.用.语.回答有关问题:

(1)最难形成简单离子的元素是____,元素⑧的最高价氧化物的水化物的化学式为_____;
(2)①与⑤能形成 9 电子微粒,其名称为____;①与⑦可组成原子个数比为 1:1的化合物甲,将⑨的单质通入甲的水溶液中,生成一种强酸且有气体放出,该反应的化学方程式为____;
(3)元素⑥、⑧形成的简单氢化物中,沸点较高的是_____,原因是____;
(4)③与⑦的单质加热条件下可发生反应,产物的化学式为____;
(5)元素④与铝性质相似,其最高价氧化物的水化物能与⑩的氢氧化物反应,离子方程 式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式如图:
①非诺洛芬的含氧官能团名称为 , ②非诺洛芬能发生的有机反应类型有 .
(2)写出下列反应的化学方程式:
①在加热、加压和催化剂条件下乙烯与水反应: .
②CH2=CHCOOCH2CH3的聚合反应: . 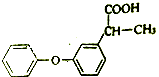
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有2 mL氯化铁溶液的试管中,加入过量铁粉,振荡试管。充分反应后滴入几滴硫氰化钾溶液,观察到的现象是_________,反应的离子方程式_________;把上层清液倒入另一试管,再加入几滴氯水,又观察到的现象是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0
B. 常温下,NH4Cl溶液加水稀释 增大
增大
C. 电解饱和食盐水产生了11.2LH2,则反应中转移的电子数为6.02×1023
D. 在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
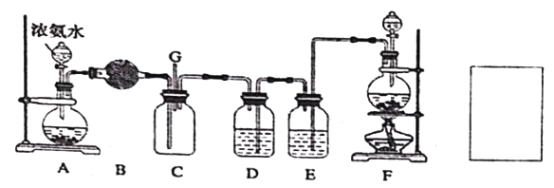
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述正确的是
A.Fe(OH)3胶体是纯净物
B.胶体是比溶液还稳定的分散系
C.胶体粒子直径在 1~100 nm之间
D.将饱和FeCl3溶液滴加到沸水中长时间加热制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性
B.碱性
C.氧化性
D.还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com