
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
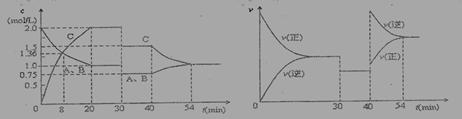
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
【知识点】速率平衡图像 外界条件对平衡的影响G2 G3 G5
【答案解析】B 解析:根据图像,A、B的浓度随时间变化是一条线,说明方程式中A、B计量系数相等,反应方程式中的x=1,则反应是一反应前后气体物质的量不变的反应,改变压强平衡不移动,A、30min时A、B、C浓度都减小,正逆速率相等,平衡不移动应该是减压,故A错误;B、30min时,向容器内再充入一定量的C,相当于加压,由于加压平衡不移动,A的体积分数不变,故B正确;C、反应方程式中的x=1正确,40min时升高温度,平衡逆向移动,逆反应为吸热反应,故C错误;D、8min前,C的平均反应速率为1.36mol/L/8min=0.17 mol·L-1·min-1,故D错误。
故答案选B
【思路点拨】本题考查了外界条件对平衡的影响,难点是从图像上得到信息,关键是灵活运用知识的能力,本题首先根据图像,A、B的浓度随时间变化是一条线,判断方程式中A、B计量系数相等。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下:

下列说法错误的是( )
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.对羟苯丙酮酸分子中有3种含氧官能团
C.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应
D.可用溴水鉴别对羟苯丙酮酸与尿黑酸
查看答案和解析>>
科目:高中化学 来源: 题型:
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式 (反应条件略去)如下:

下列叙述错误的是
A. FeCl3溶液可区别阿司匹林和扑热息痛
B.1 mol贝诺酯最多可消耗3 mol NaOH
C.常温下,贝诺酯在水中的溶解度小于扑热息痛
D.与阿司匹林互为同分异构体,且1 mol能与足最NaHCO3溶液反应产生2mo1CO2的结构为10种
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
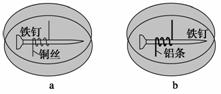
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 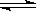 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
E.容器中气体密度不变 F.1mol H—H键断裂的同时断裂2 mol H-O键
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 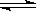 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
3min—4min达到平衡时CO的平衡浓度c3= (c3精确到小数点后面三位数),CO2 (g)的转化率= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A 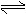 H++HA-,HA-
H++HA-,HA-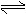 H++A2-
H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
在A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入几滴饱和FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A ,B ,C 。
(2)写出A中形成分散系的离子方程式: 。
(3)写出C中形成分散系的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com