
| A、在0.1mol氢氧化钠中,阴、阳离子的个数比为1:1 |
| B、标准状况下,如果11.2LO2含有n个氧分子,则NA为2n |
| C、22.4L氢气所含原子数目为2NA |
| D、标准状况下,18克的水物质的量为1mol |
| V |
| Vm |
| m |
| M |
| 11.2 |
| 22.4 |
| 18g |
| 18g/mol |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
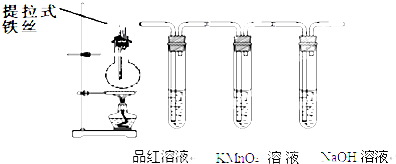
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解质的水溶液中存在电离平衡.
电解质的水溶液中存在电离平衡.| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol?L-1 AgNO3溶液中加入2mL 0.005mol?L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol?L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol?L-1AgNO3溶液. | |
| 步骤4:向步骤1余下的浊液中加入5滴3mol?L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+ |
| B、Na+ |
| C、OH- |
| D、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
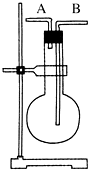 ①H2②Cl2③NH3④O2⑤CH4⑥NO ⑦NO2⑧SO2⑨HCl.
①H2②Cl2③NH3④O2⑤CH4⑥NO ⑦NO2⑧SO2⑨HCl.| A、在烧瓶中充满水,由B进气收集④⑥ |
| B、在烧瓶中充满水,由A进气收集①③⑤⑥⑦ |
| C、烧瓶是干燥的,由B进气收集②④⑥⑦⑧⑨ |
| D、烧瓶是干燥的,由A进气收集①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、松花蛋是一种常用食品,食用时有氨的气味,可以蘸些食醋除去 |
| B、“皮革奶”是奶粉中掺入皮革下脚料,将皮革灼烧时有烧焦羽毛的气味 |
| C、腌制食品中应严格控制NaNO2的用量 |
| D、从海水中可提取Mg,用惰性电极电解熔融的MgCl2或其水溶液都可制得Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃甲烷不必事先进行验纯 |
| B、甲烷燃烧放出大量的热,所以是一种很好的气体燃料 |
| C、煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生 |
| D、点燃混有空气的甲烷不一定会爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃和亚硫酸钠长期暴露在空气中均易变质 |
| B、浓硝酸和氯水均用棕色试剂瓶保存 |
| C、NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
| D、浓硫酸和浓盐酸长期暴露在空气中浓度均降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com