
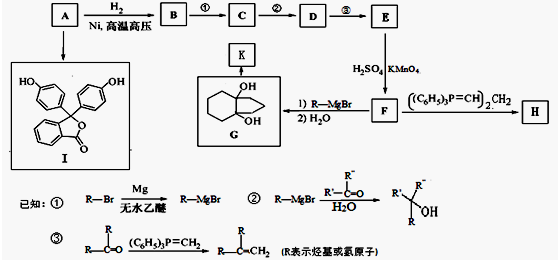
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 ,A和氢气发生加成反应生成B为:
,A和氢气发生加成反应生成B为: ,B经过系列反应得到F,F发生信息②的反应得到G,结合B的结构可知F为
,B经过系列反应得到F,F发生信息②的反应得到G,结合B的结构可知F为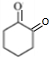 ,综合B、F的结构推知,C为
,综合B、F的结构推知,C为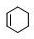 D可以为
D可以为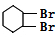 ,E为
,E为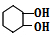 ,F发生信息③的反应生成H,G反应得到K,且H和K互为同分异构体
,F发生信息③的反应生成H,G反应得到K,且H和K互为同分异构体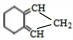 、K为
、K为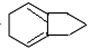 ,据此解答.
,据此解答. ,A和氢气发生加成反应生成B为:
,A和氢气发生加成反应生成B为: ,B经过系列反应得到F,F发生信息②的反应得到G,结合B的结构可知F为
,B经过系列反应得到F,F发生信息②的反应得到G,结合B的结构可知F为 ,综合B、F的结构推知,C为
,综合B、F的结构推知,C为 D可以为
D可以为 ,E为
,E为 ,F发生信息③的反应生成H,G反应得到K,且H和K互为同分异构体
,F发生信息③的反应生成H,G反应得到K,且H和K互为同分异构体 、K为
、K为 ,
, ,故答案为:
,故答案为: ;
;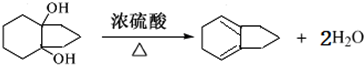 ,
, ;
; 的合成路线流程图为:
的合成路线流程图为: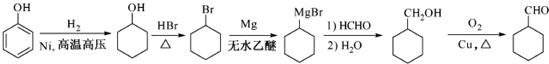 ,
, .
.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Br2蒸气和NO2都是红棕色气体 | 可用淀粉碘化钾水溶液鉴别 |
| B | BaSO4和BaCO3都是难溶物 | 医疗上都能用作“钡餐” |
| C | SO2有漂白性 | SO2可使溴水褪色 |
| D | Fe3+水解成胶体可吸附水中的悬浮物 | Fe2(SO4)3可以做净水剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使高锰酸钾酸性溶液褪色 |
| B、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| C、苯酚能和氢氧化钠溶液反应,而乙醛不能和氢氧化钠溶液反应 |
| D、苯酚苯环上的氢比苯分子中的氢更容易被卤原子取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:
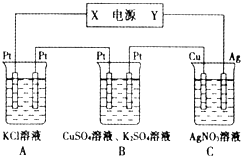 Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.
Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年冬季,雾霾天气多次肆虐我国东部地区.其中汽车尾气是造成空气污染的原因之一,研究控制汽车尾气成为保护环境的首要任务.
2013年冬季,雾霾天气多次肆虐我国东部地区.其中汽车尾气是造成空气污染的原因之一,研究控制汽车尾气成为保护环境的首要任务.| 催化剂 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )| A、C点的溶液:c(CH3COO-)+c(CH3COOH)>c(Na-) |
| B、B点的溶液:c(CH3COO-)>(Na+)>c(H-)>c(OH-) |
| C、A点的纵坐标值为1 |
| D、D点溶液2c(CH3COOH)+c(H+)=c(OH-)-c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com