
【题目】研究金属腐蚀和防腐的原理很有现实意义.

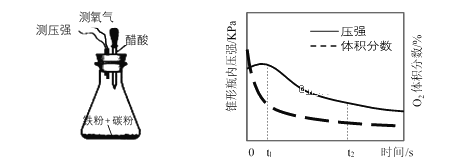
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置,某兴趣小组按装置试验,导管中液柱的上升缓慢,为更快更清晰地观察到液柱上升的现象,下列措施错误的________(填序号)
A.用纯氧气代替试管内空气
B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末
D.换成更细的导管,水中滴加红墨水
(2)为探究铁钉腐蚀实验a、b两点所发生的反应,张老师进行以下实验,证明铁发生电化学腐蚀。请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
ⅰ.向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为_______________ |
ⅱ.然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为_______________ 沉淀的化学式为______________ |
(3)孔老师认为仅通过b中现象不能证明铁发生了电化学腐蚀,补充进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 现象 |
1.0 mol·L-1NaCl溶液 | 0.5 molL﹣1K3[Fe(CN)6]溶液 | 铁片表面产生大量蓝色沉淀 |
以上实验表明,K3[Fe(CN)6]具有________性
(4)赵老师设计下面装置研究弱酸性环境中腐蚀的主要形式,测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_________腐蚀(填吸氧或析氢)
(5)金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极置于H2SO4溶液中,一定条件下Fe表面形成致密Fe3O4氧化膜,试写出该阳极电极反应式_________。
【答案】B ![]()
![]()
![]() 氧化 吸氧
氧化 吸氧 ![]()
【解析】
⑴A.用纯氧气代替试管内空气,氧气浓度大,反应速率加快;B.用酒精灯加热试管提高温度,由于温度升高,气体压强增大,导管中液面反而下降;C.将铁钉换成铁粉和炭粉混合粉末,形成更多的原电池,加快腐蚀速度;D.换成更细的导管,水中滴加红墨水,液面上升更明显。
⑵ⅰ. a点附近溶液出现红色,说明a点反应生成了氢氧根;ⅱ. b点周围出现蓝色沉淀,说明b点生成了亚铁离子。
⑶铁和K3[Fe(CN)6]反应生成蓝色沉淀,说明发生氧化还原反应。
⑷t1~t2之间氧气体积分数减小,说明氧气在消耗。
⑸金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极,在一定条件下铁失去电子与水反应生成致密的四氧化三铁氧化膜。
⑴A.用纯氧气代替试管内空气,氧气浓度大,反应速率加快,故A不符合题意;B.用酒精灯加热试管提高温度,由于温度升高,气体压强增大,导管中液面反而下降,故B符合题意;C.将铁钉换成铁粉和炭粉混合粉末,形成更多的原电池,加快腐蚀速度,故C不符合题意;D.换成更细的导管,水中滴加红墨水,液面上升更明显,故D不符合题意;综上所述,答案为B。
⑵ⅰ.向NaCl溶液中滴加2~3滴酚酞指示剂,a点附近溶液出现红色,说明a点反应生成了氢氧根,因此a点电极反应为![]() ;故答案为:
;故答案为:![]() 。
。
ⅱ.然后再滴加2~3滴铁氰化钾溶液,b点周围出现蓝色沉淀,说明b点生成了亚铁离子,亚铁离子迅速与铁氰化钾溶液反应,因此b点电极反应为![]() ,沉淀的化学式为
,沉淀的化学式为![]() ;故答案为:
;故答案为:![]() ;
;![]() 。
。
⑶铁和K3[Fe(CN)6]反应生成蓝色沉淀,发生氧化还原反应,K3[Fe(CN)6]化合价降低,具有氧化性,故答案为:氧化。
⑷t1~t2之间氧气体积分数减小,说明氧气在消耗,主要发生吸氧腐蚀;故答案为:吸氧。
⑸金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极置于H2SO4溶液中,一定条件下铁失去电子与水反应生成致密的四氧化三铁氧化膜,阳极电极反应式![]() ;故答案为:
;故答案为:![]() 。
。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】以下实验原理或操作中,正确的是![]()
A.用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高
B.仰视量筒刻度量取一定量浓硫酸所配制的![]()
![]()
![]() 溶液的浓度结果偏低
溶液的浓度结果偏低
C.焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色
D.要将溶解在![]() 中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯

乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“固定CO2”的电化学装置如图。该电化学装置放电时可将CO2转化为C和Li2CO3,充电时仅使Li2CO3发生氧化反应释放出CO2和O2,下列说法正确的是
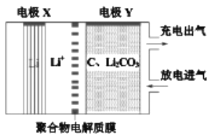
A.放电时,Li+向电极X方向移动
B.放电时,每转移4 mol e-,理论上生成 1 mol C
C.充电时,阳极反应:C+2Li2CO3-4e-=3CO2↑+4Li+
D.充电时,电极Y与外接直流电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
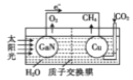
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用取得了突破性的进展。一种镍催化法生产GaN的工艺如图:

(1)“热转化”时Ga转化为GaN的化学方程式是_____。
(2)“酸浸”的目的是_____,“操作Ⅰ”中包含的操作是_____。
某学校化学兴趣小组在实验室利用图装置模拟制备氮化镓:

(3)仪器X中的试剂是_____,仪器Y的名称是_____,装置G的作用是_____。
(4)加热前需先通入一段时间的H2,原因是_____。
(5)取某GaN样品m克溶于足量热NaOH溶液,发生反应 GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
(6)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,成功地实现了用CO2和H2O合成CH4,请写出铜极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的理解正确的是
A. 2-丁醇的结构简式:![]()
B. 电子式 ![]() : 可以表示羟基,也可以表示氢氧根离子
: 可以表示羟基,也可以表示氢氧根离子
C. 比例模型 ![]() :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
D. 聚丙烯的结构简式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:下列有关说法不正确的是
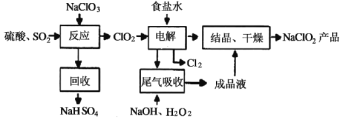
A.NaClO2中Cl的化合价+3价
B.“反应”步骤中生成ClO2的化学方程式2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4
C.“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液和Na2CO3溶液
D.“尾气吸收”是吸收“电解”过程排出的少量ClO2,反应中,氧化剂与还原剂的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图。下列有关化合物甲、乙的说法正确的是

A.甲→乙的反应为加成反应
B.甲分子中至少有 8 个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有 4 个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com