
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚___;
(2)甲苯制TNT___;
(3)乙醇与浓硫酸共热消去反应___;
(4)乙二醇和乙二酸脱水成六元环的酯___;
(5)乙醛和银氨溶液反应___。
【答案】n![]()
![]()
![]()
![]() +3HNO3
+3HNO3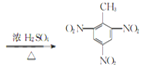 +3H2O CH3CH2OH
+3H2O CH3CH2OH![]() CH2=CH2↑+H2O HOCH2CH2OH+HOOC—COOH
CH2=CH2↑+H2O HOCH2CH2OH+HOOC—COOH![]()
 +2H2O CH3CHO+2Ag(NH3)2OH
+2H2O CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
【解析】
(1)丙烯含有碳碳双键,加聚反应方程式为n![]()
![]()
![]() ;
;
(2)TNT即2,4,6-三硝基甲苯,甲苯和浓硝酸在浓硫酸、加热的条件下发生取代反应生成TNT,化学方程式为![]() +3HNO3
+3HNO3![]()
 +3H2O;
+3H2O;
(3)乙醇在浓硫酸、170℃的条件下发生消去反应,化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(4)乙二醇和乙二酸在浓硫酸加热的条件下发生酯化反应,化学方程式为HOCH2CH2OH+HOOC—COOH![]()
 +2H2O;
+2H2O;
(5)乙醛可以被银氨溶液氧化,化学方程式为CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O。
CH3COONH4+2Ag↓+3NH3+H2O。


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的装置如下图所示,请根据图示回答下列问题:
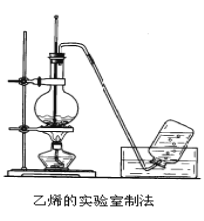
(1)实验室制乙烯的化学方程式为_____在这个反应中,浓硫酸的作用是_____________________和______________。
(2)某化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫, 老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有 C2H4 和 SO2。
回答下列问题:
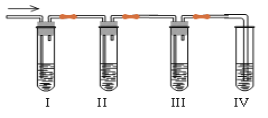
品红溶液 NaOH 溶液 品红溶液酸性KMnO4 溶液
①能说明 SO2 气体存在的现象是____________________。
②确定含有乙烯的现象是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是______________(用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-)___________(填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)=____________mol/L, c(OH-)- c(HA)=____________mol/L
常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH_________7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH___________7(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置__________________________。
(2)用电子式表示D2G的形成过程____________________________,其所含化学键类型为___________。
(3)C2-、D+、G2-离子半径由大到小顺序是____________________(用离子符号回答)。
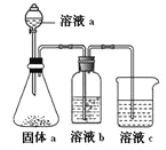
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为______________,________________。
②溶液c中的离子方程式为________________________________________。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为_____________________________________。
②用一个离子方程式表示该反应__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下体积为1mL、浓度均为![]() 的XOH和
的XOH和![]() 溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是![]()
![]()
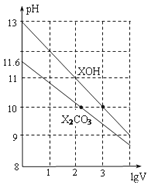
A.![]() 的两种溶液中的
的两种溶液中的![]() 大于
大于![]()
B.已知常温下,![]()
![]()
![]() 溶液的
溶液的![]() ,则
,则![]()
![]()
C.![]() 的二级电离平衡常数
的二级电离平衡常数![]() 约为
约为![]()
D.升高温度![]() 溶液的pH增大,XOH溶液pH减小
溶液的pH增大,XOH溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25![]() C时,水的电离平衡:H2O
C时,水的电离平衡:H2O![]() H++OH-
H++OH-![]() H>0,下列叙述正确的是
H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D.将水加热,Kw增大,c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水中存在电离平衡NH3·H2O![]() NH4++OH-,下列叙述不正确的是( )
NH4++OH-,下列叙述不正确的是( )
A.氨水中离子浓度的关系满足:c(OH-)=c(H+)+c(NH4+)
B.0.10mol/L的NH3·H2O溶液加水稀释,溶液中c(H+)减小
C.NH3·H2O溶液中加少量的NH4Cl固体,平衡逆向移动
D.常温下pH=2的盐酸溶液与pH=12的NH3·H2O溶液等体积混合后,溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
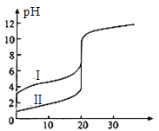
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应:
,发生反应:![]() 经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列说法正确的是![]()
A.反应在前2s的平均速率![]()
B.保持其他条件不变,体积压缩到![]() ,平衡常数将增大
,平衡常数将增大
C.相同温度下,起始时向容器中充入![]() ,达到平衡时,
,达到平衡时,![]() 的转化率等于
的转化率等于![]()
D.保持温度不变,向该容器中再充入![]() 、
、![]() ,反应达到新平衡时
,反应达到新平衡时![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com